AACR速报:康方生物PD-1/CTLA-4双特异性抗体联合方案一线治疗晚期胃癌3期临床数据优异
来源:生物世界 2024-04-11 10:17
该研究纳入了610名未经治疗、不可切除、HER2阴性、局部晚期或转移性G/GEJ癌症患者。患者被1:1随机分配接受Cadonilimab联合卡培他滨/奥沙利铂化疗或安慰剂联合化疗。
2024年4月5日,备受瞩目的第115届美国癌症研究协会(AACR 2024)年会在美国圣地亚哥开幕,作为癌症研究界的焦点,科学家、临床医生及世界各地的癌症研究人员在这里分享癌症研究和治疗的最新进展。
4月7日,北京大学肿瘤医院季加孚教授在 AACR 大会上报告了PD-1/CTLA-4双特异性抗体Cadonilimab联合化疗对比化疗用于一线治疗不可切除的局部晚期或转移性胃或胃食管结合部(G/GEJ)腺癌的随机、双盲、3期临床试验(COMPASSION-15)。这也是全球首个PD-1/CTLA-4双特异性抗体联合化疗一线治疗胃癌的3期临床研究。

季加孚教授
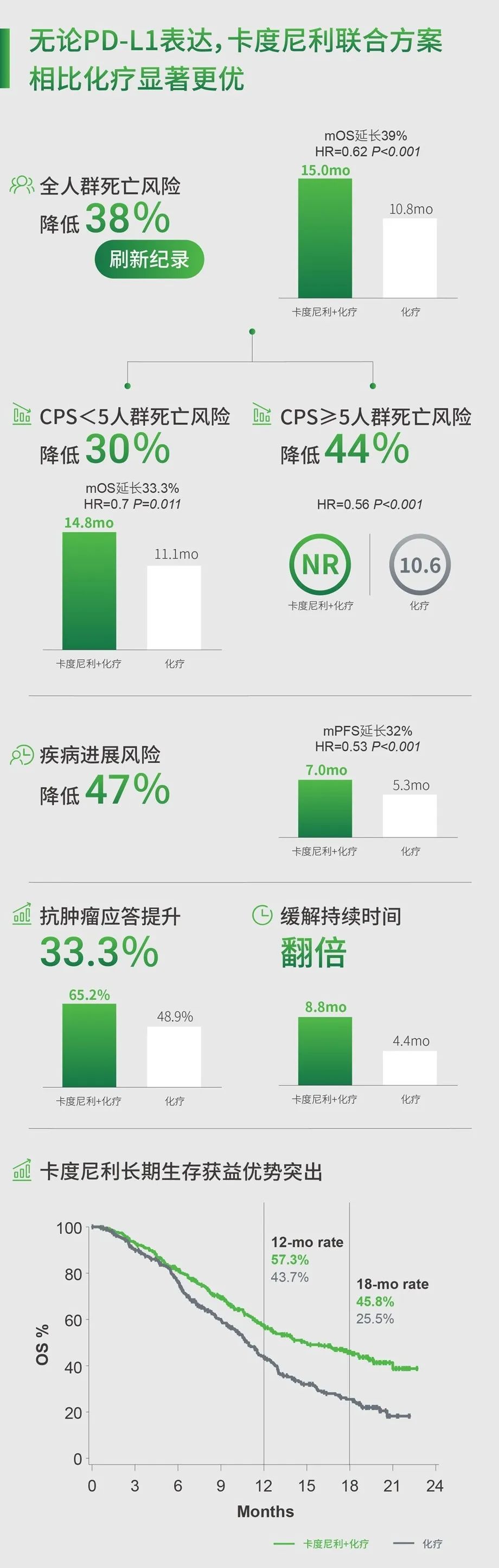
结果显示,与单独化疗相比,PD-1/CTLA-4双特异性抗体Cadonilimab联合化疗改善了未经治疗的HER2阴性局部晚期或转移性胃或胃食管结合部(G/GEJ)癌症患者的无进展生存期和总生存期,包括PD-L1低表达的患者。
这些发现可能会改变目前胃癌治疗实践,Cadonilimab联合化疗可能成为胃癌一线治疗的新标准,即使是对PD-L1低表达患者。
免疫检查点抑制剂(ICI),包括靶向PD-1/PD-L1免疫检查点通路的单抗,已被美国FDA批准用于HER2阴性胃或胃食管结合部(G/GEJ)癌症的一线治疗。然而,ICI通常对肿瘤中高表达PD-L1的患者最有效。肿瘤低表达PD-L1的患者治疗选择有限。在许多国家,化疗是这些患者的最佳治疗选择,但他们的总生存期不到一年。
因此,对于PD-L1低表达、HER2阴性的G/GEJ癌症癌症患者,探索新的治疗方案有很大的医疗需求未得到满足。
Cadonilimab(开坦尼)是康方生物(9926.HK)自主研发的PD-1/CTLA-4双特异性抗体,可同时阻断PD-1和CTLA-4这两个免疫检查点。该药物于2022年6月在中国获批用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗,这也是全球首个获批上市的肿瘤双免疫检查点双抗新药。
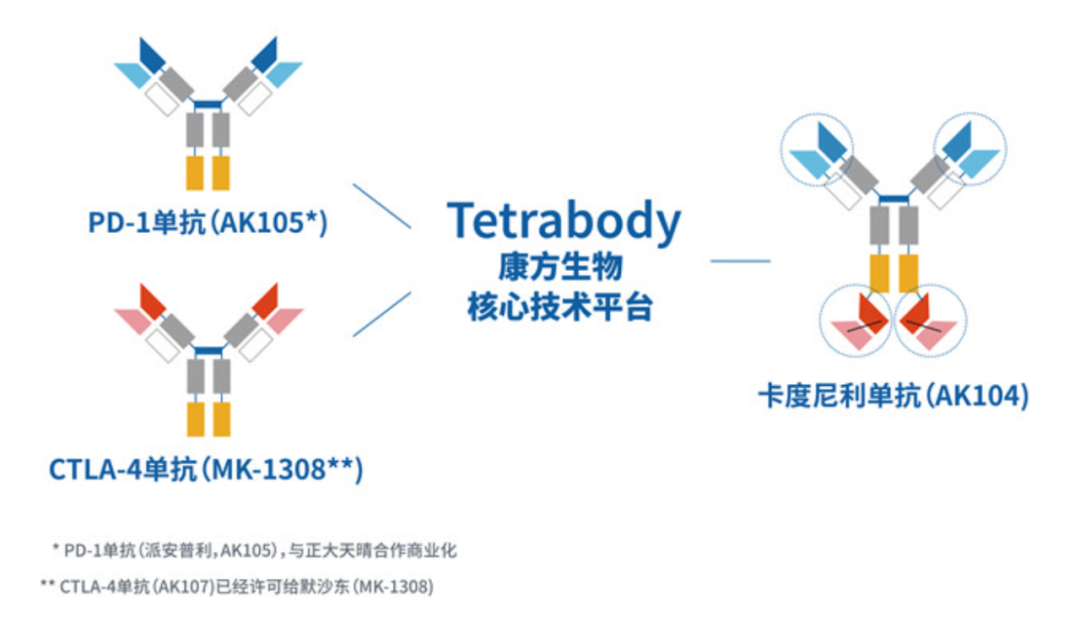
季加孚教授、沈琳教授团队启动了这项名为COMPACTION-15的临床试验,这也是全球首个PD-1/CTLA-4双特异性抗体联合化疗一线治疗胃癌的3期临床研究.该研究纳入了610名未经治疗、不可切除、HER2阴性、局部晚期或转移性G/GEJ癌症患者。患者被1:1随机分配接受Cadonilimab联合卡培他滨/奥沙利铂化疗或安慰剂联合化疗。
总体而言,联合治疗组患者的中位无进展生存期为7个月,中位总生存期为15个月,而安慰剂组患者的中位无进展生存期为5.3个月,中位总生存期为10.8个月。联合治疗组的总缓解率为65.2%,中位缓解持续时间为8.8个月,安慰剂组的总缓解率为48.9%,中位缓解持续时间为4.4个月。
此外,联合治疗在PD-L1低表达的患者亚组中也观察到了生存获益,他们的无进展生存期为6.9个月,总生存期为14.8个月,而安慰剂组分别为4.6个月和11.1个月。
季教授表示,PD-L1低表达的肿瘤可能依赖于其他免疫检查点(例如CTLA-4),因此可能对CTLA-4阻断有反应。PD-1和CTLA-4的双重阻断可能提高PD-L1低表达肿瘤患者对免疫治疗的敏感性。此外,这两种双特异性抗体的靶标之间可能存在协同作用,这还需要进一步的机制研究。
上述数据为COMPASSION-15临床试验的中期分析数据,研究团队将继续监测接受治疗的患者以评估长期治疗结果。同时,康方生物已向中国国家药品监督管理局提交了卡度尼利联合化疗一线治疗晚期胃或胃食管结合部腺癌的新药上市许可申请(NDA),目前已获受理。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


