《自然·医学》:应答=长生存,4年DFS率超60%!免疫+化疗新辅助治疗用于胃/胃食管交界部癌再传捷报
来源:奇点糕 2024-01-11 11:30
在免疫治疗狂飙突进的这个时代里,一颗种子成长为参天大树的进程,好像都开了16倍速,比如非小细胞肺癌(NSCLC)的新辅助治疗
在免疫治疗狂飙突进的这个时代里,一颗种子成长为参天大树的进程,好像都开了16倍速,比如非小细胞肺癌(NSCLC)的新辅助治疗,从2018年首个标志性的早期研究成果登上《新英格兰医学杂志》,到2022年关键III期研究再度登顶,也不过只用了短短4年。
而在其它实体瘤的围术期治疗中,免疫治疗们也正一步一个脚印前进,如果能从早期研究观察到出色的疗效数据,推进关键研究的信心和动力就更足。《自然·医学》期刊刚刚发表的一项最新研究成果,就能给胃/胃食管交界处腺癌(G/GEJ)的新辅助治疗注入“强心针”!
由荷兰学者开展的临床II期PANDA研究4年随访结果显示:对可手术G/GEJ患者的新辅助治疗,采用PD-L1抑制剂阿替利珠单抗配合多西他赛+奥沙利铂+卡培他滨三药化疗方案,可使45%(n=9)的患者实现病理学完全缓解(pCR),70%(n=14)的患者实现主要病理学缓解(MPR),且14例pCR/MPR患者有13例实现了长达4年的无病生存[1],预后远远好于未达病理缓解的患者,展现了免疫治疗“达到缓解、持久获益、长期生存”的特点。

论文首页截图
与各位耳熟能详的胃癌相比,胃食管交界处癌或许名气没有那么大,但它的发病率也处于快速上升之中,且在欧美国家确诊的胃食管交界处癌组织学类型基本均属腺癌,与欧美国家的食管癌组织学类型相似(而我国及亚洲国家多为鳞癌),治疗模式也大体相近[2]。
因此可手术胃食管交界处癌的治疗,也面临着与可手术胃癌、食管癌相似的困境,那就是以手术为主、围术期化疗/放化疗为辅的策略,并不能大幅提升患者的术后长期生存率,而在晚期胃癌、食管癌治疗中相继破局后,免疫治疗就当仁不让地要挑起重担了。
PANDA研究正是免疫+化疗联合新辅助治疗在G/GEJ中的早期标志性探索,值得注意的是,该研究在设计上采用先诱导、再联合的新辅助治疗策略,即首先使用阿替利珠单抗治疗1个周期,再联合多西他赛+奥沙利铂+卡培他滨三药化疗方案治疗4个周期,且患者术后并不接受标准辅助治疗,专门评估免疫+化疗联合新辅助治疗的获益。
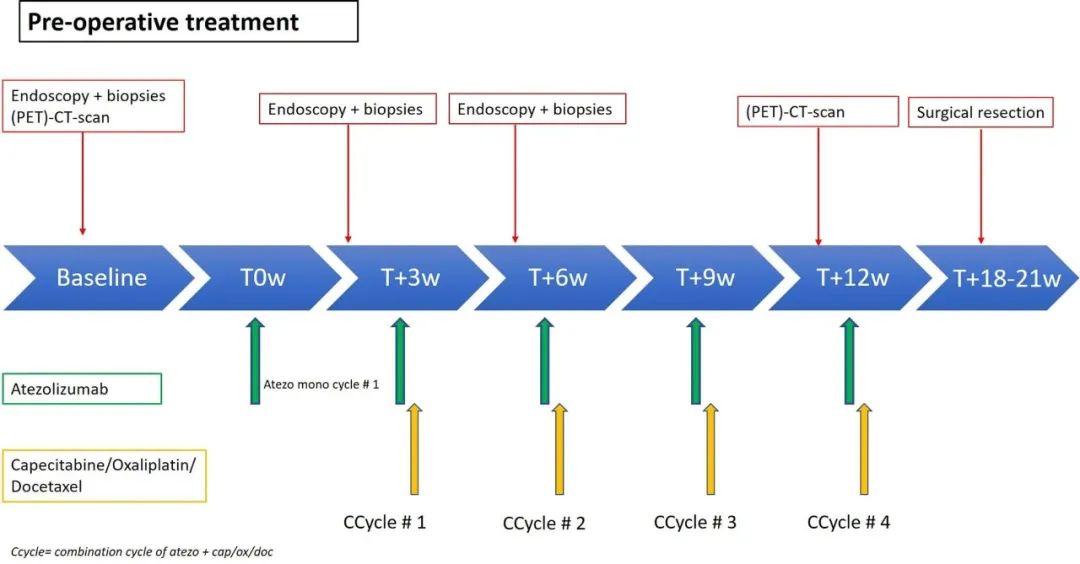
PANDA研究整体方案设计
此前PANDA研究的疗效数据就多次亮相国际级学术会议,比如45%的pCR率、70%的MPR率,15例患者无病生存达到两年半等等,本次刊发的研究结果还显示,联合新辅助治疗的病理缓解不受临床分期、是否存在错配修复缺陷(dMMR)或组织学亚型(肠型/混合型)等因素的影响,且未达病理缓解的患者肿瘤内残存癌细胞(RVT)也减少了60-70%。
而且,本次公布的研究4年随访结果(中位随访时间47个月),则充分证实了免疫+化疗联合新辅助治疗的长期生存获益:未达病理缓解的6例患者有5例已因病去世,且这部分患者从手术到疾病复发的中位时间仅有10个月,复发到去世的中位时间同样仅有10个月;而达到病理缓解的14例患者中,仅有1例发生DFS事件,中位DFS和OS均显著更长。
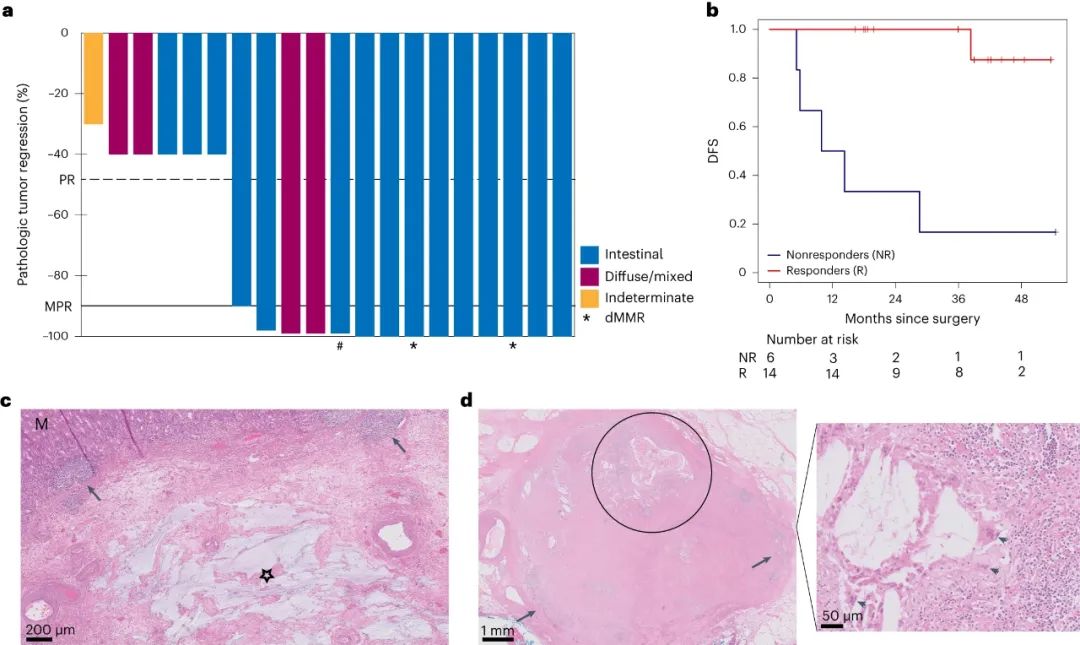
联合新辅助治疗病理缓解与患者DFS结局的关系
研究者们还开展了ctDNA、治疗应答标志物等层面的分析,并得到了一些初步发现,例如术后检测分子残留病灶(MRD)时,ctDNA阳性患者的复发风险更高,而PD-L1综合细胞分数(CPS)和肿瘤突变负荷(TMB)并不具有预测效能;此外,病理应答较好患者的肿瘤中,基线时即普遍存在肿瘤反应性CD8+T细胞,如CD8+PD-1+T细胞和CD103+CD8+T细胞浸润,免疫检查点SIGLEC-7和肥大细胞标志性基因特征的水平也显著更高。
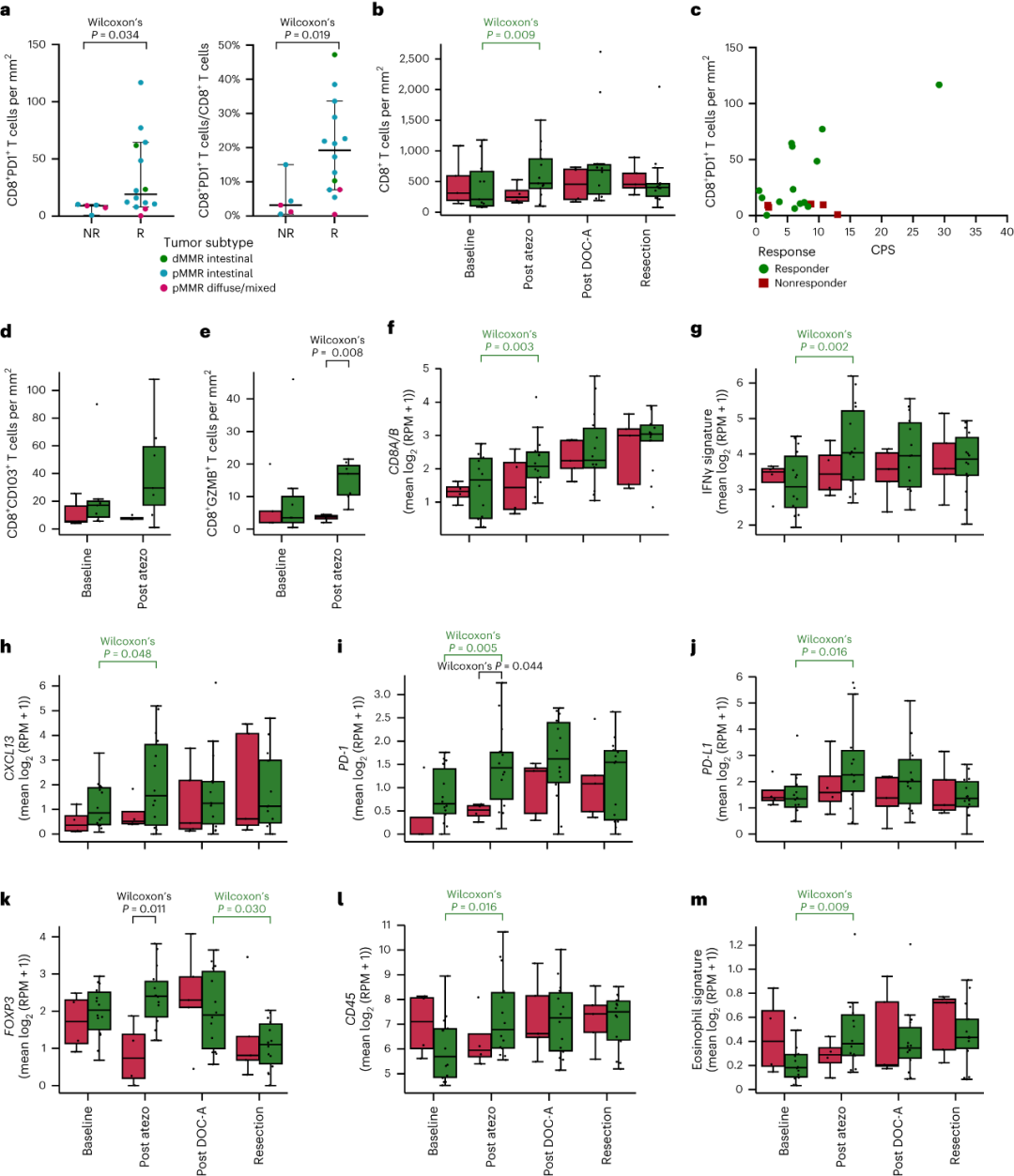
病理缓解与未缓解患者的CD8+T细胞浸润差异
基于对不同时间点患者肿瘤样本及血样的分析,研究者们还证实免疫治疗是重塑G/GEJ免疫微环境的关键:在初步的阿替利珠单抗诱导治疗后,患者的CD8+T细胞即被有效激活,抗肿瘤活性显著增强,且病理缓解患者的CD8+T细胞浸润,并未在后续联合治疗阶段进一步显著上升,此外嗜酸性粒细胞相关基因、免疫检查点LAG3表达也呈类似趋势。
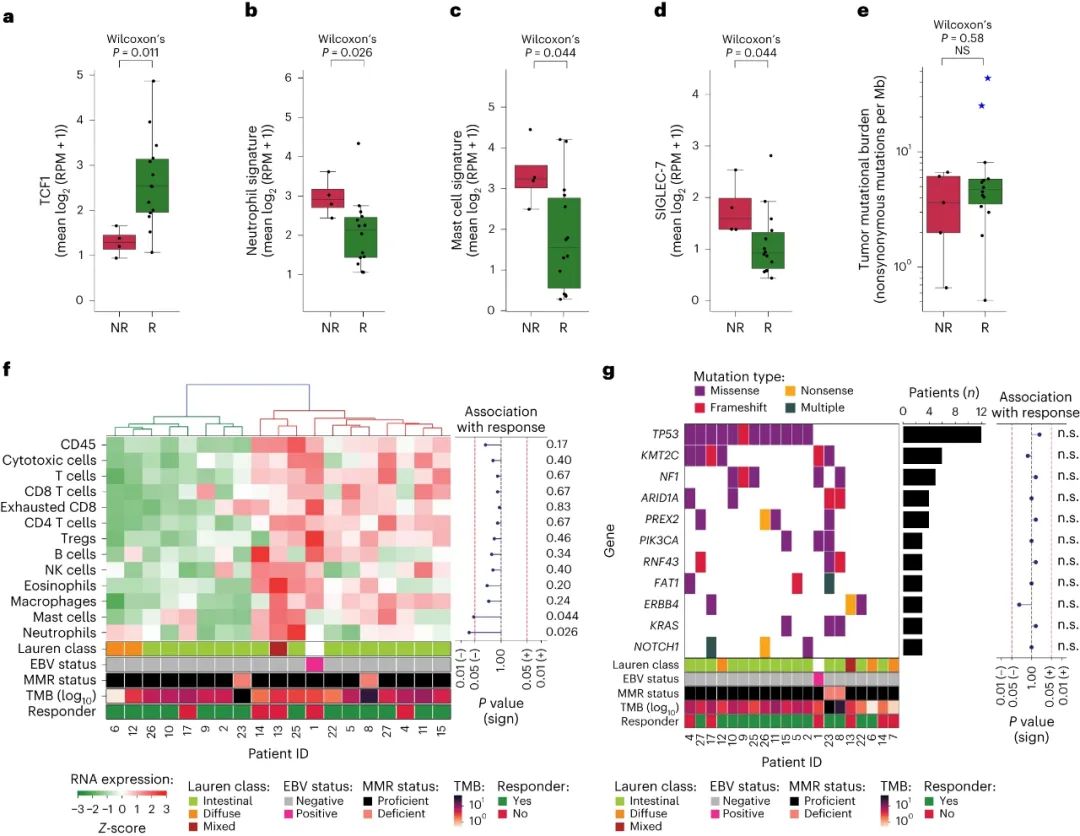
病理缓解与未缓解患者的关键基因表达、免疫浸润状况差异
虽说不久前,免疫+化疗新辅助治疗用于G/GEJ的一项关键临床III期研究意外失利,未能显著延长患者无事件生存期(EFS)和总生存期(OS)[3],但这并不意味着免疫治疗在G/GEJ围术期治疗中彻底失去前景,如果采用PANDA研究的治疗模式,结局会不会大不相同呢?奇点糕当然期待的是一个圆满的结果~
参考文献:
[1]Verschoor Y L, Van De Haar J, Van Den Berg J G, et al. Neoadjuvant atezolizumab plus chemotherapy in gastric and gastroesophageal junction adenocarcinoma: the phase 2 PANDA trial[J]. Nature Medicine, 2024.
[2]Lin D, Khan U, Goetze T O, et al. Gastroesophageal junction adenocarcinoma: is there an optimal management?[J]. American Society of Clinical Oncology Educational Book, 2019, 39: e88-e95.
[3]Shitara K, Rha S Y, Wyrwicz L S, et al. Neoadjuvant and adjuvant pembrolizumab plus chemotherapy in locally advanced gastric or gastro-oesophageal cancer (KEYNOTE-585): an interim analysis of the multicentre, double-blind, randomised phase 3 study[J]. The Lancet Oncology, 2023.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


