《肝病学》:中山大学附属第三医院团队揭秘癌基因通过掺假促进肝癌进展的机制
来源:奇点糕 2023-12-11 10:25
该研究从分子水平上揭示了PUS1促进HCC进展的机制,即PUS1通过介导mRNA假尿苷化来调控致癌基因的翻译,促进HCC的发展。这一发现也给基于RNA修饰的HCC治疗策略提供了理论基础。
近期,中山大学附属第三医院肖振东团队发表了的一篇文章,揭示了PUS1促进HCC进展的机制。他们发现,PUS1可将假尿苷嵌入到一些致癌基因(IRS1、c-MYC、SHMT2和MDM2)的mRNA上,提高了这些mRNA的翻译效率,进一步增加了IRS1、c-MYC、SHMT2和MDM2的蛋白水平,最终促进了HCC的进展。
研究发表在《肝病学》上[1]。

论文首页截图
为了探究PUS1与HCC进展之间的关系,研究人员首先分析了TCGA数据集,结果发现,在包括HCC在内的14个癌肿中均能观察到PUS1表达上调的现象。UALCAN在线分析进一步表明,PUS1表达上调与HCC分期和分级更差显著相关。从KM曲线中,研究人员同样发现,高表达PUS1的患者整体生存率和无病生存率均较差。
随后研究人员在分析23对HCC患者肿瘤组织和邻近正常组织样本后发现,PUS1在肿瘤组织中的表达水平的确高于邻近正常组织。
为了进一步分析PUS1在HCC发展过程中的作用,研究人员通过高压水动力尾静脉注射(HTVi)构建了小鼠原发HCC模型。结果发现,和人类类似,相较正常组织,小鼠肿瘤组织中也出现PUS1表达上调的现象。当研究人员敲除PUS1并重新构建HCC小鼠模型后发现,与对未敲除的对照组相比,PUS1敲除小鼠肿瘤体积明显变小了。相反,当PUS1过表达时,相比对照组,过表达PUS1的小鼠肿瘤体积又明显变大了。这也意味着,PUS1在小鼠HCC发展中起到了一个推动的作用。
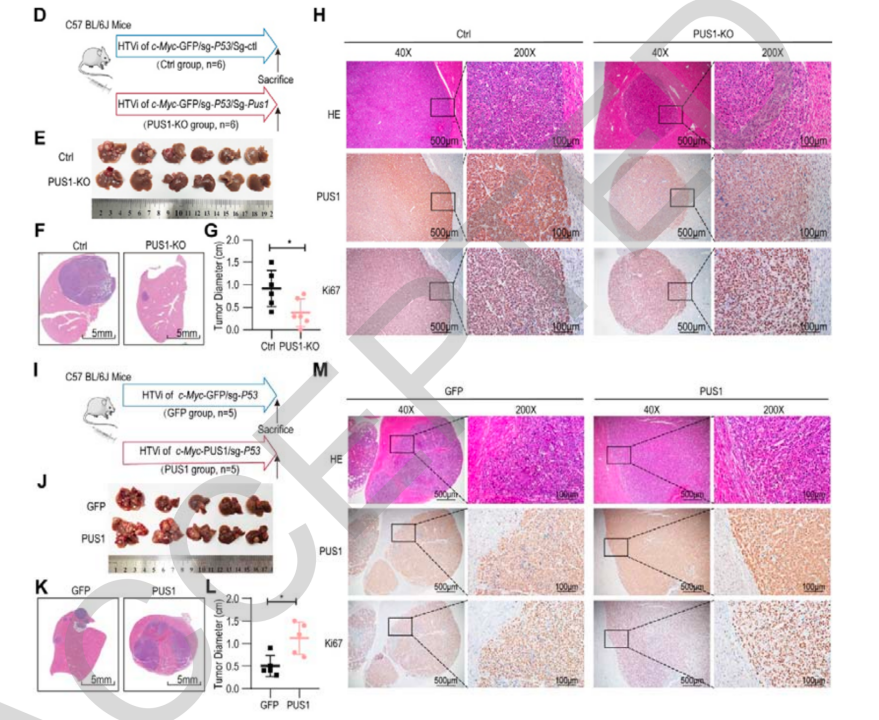
敲除PUS1、过表达PUS1的小鼠的肿瘤体积
接下来,研究人员又进行了体外实验,在一系列可检测到PUS1表达的人类HCC细胞系中,研究人员选取了HCCLM3和PLC/PRF/5这两个细胞系来验证PUS1的促癌能力。在建立稳定敲除PUS1的细胞后,研究人员发现,PUS1的缺失显著抑制了HCC细胞的增殖,异种移植小鼠模型的结果也进一步验证了这一发现,即敲除PUS1后,小鼠肿瘤体积和重量明显减少。
相反,当研究人员建立稳定过表达PUS1细胞系后发现,PUS1的过表达明显增加了HCC细胞的活性,在异种移植小鼠模型中,PUS1过表达后,小鼠肿瘤生长速度比对照组更快。以上体内外研究结果显示,PUS1的过表达的确促进了HCC细胞的增殖。
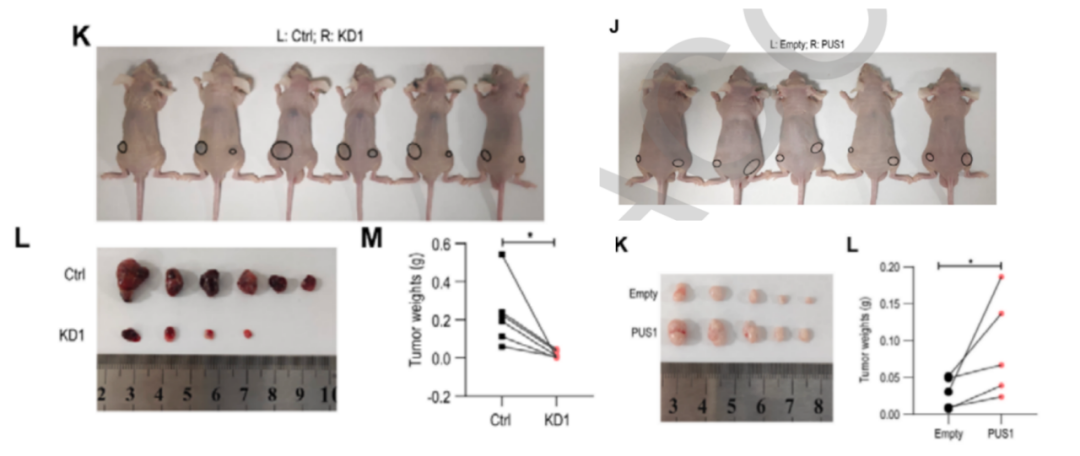
异种移植后小鼠肿瘤变化情况
PUS1毕竟是一种假尿苷合成酶,可以修饰mRNA。所以研究人员猜想,PUS1促进HCC进展可能与PUS1导致的假尿苷化有关。
为了验证这一猜想,研究人员进行了点印记分析,评估了HCC细胞中mRNA的假尿苷水平。结果发现,过表达PUS1会导致HCC细胞中mRNA假尿苷水平上升,而敲除PUS1则会导致假尿苷水平下降。随后通过突变PUS1的活性位点,研究人员发现,活性丧失后的PUS1就不会促进HCC细胞增殖了。
机制上,研究人员通过STAMP技术(检测蛋白质-RNA相互作用的方法,可将PUS1融合到胞嘧啶脱氨酶APOBEC1上,定位假尿苷化的mRNA靶点)发现,PUS1可将假尿苷嵌入到一些致癌基因(IRS1、c-MYC、SHMT2和MDM2)的mRNA中,来提高这些mRNA的翻译效率,从而增加这些致癌基因的蛋白水平,最终促进了HCC的进展。
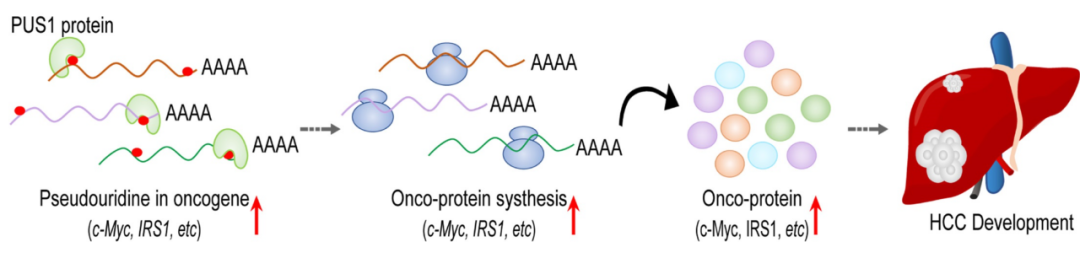
研究机制图
总之,该研究从分子水平上揭示了PUS1促进HCC进展的机制,即PUS1通过介导mRNA假尿苷化来调控致癌基因的翻译,促进HCC的发展。这一发现也给基于RNA修饰的HCC治疗策略提供了理论基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


