Cell Death & Differentiation: HUWE1可以同时拮抗异常铁蓄积和铁死亡减轻急性肝损伤
来源:本站原创 2022-03-26 13:19
肝损伤和肝细胞死亡是所有肝病的共同特征。肝移植是终末期肝病公认的挽救生命的治疗方法。然而,由于器官移植的技术特点,热缺血/再灌注(I/R)损伤是最具挑战性的问题之一。因此,了解肝移植中I/R等急性肝损伤的发病机制具有重要意义。肝脏的细胞死亡主要是通过细胞凋亡或坏死来实现的。
肝损伤和肝细胞死亡是所有肝病的共同特征。肝移植是终末期肝病公认的挽救生命的治疗方法。然而,由于器官移植的技术特点,热缺血/再灌注(I/R)损伤是最具挑战性的问题之一。因此,了解肝移植中I/R等急性肝损伤的发病机制具有重要意义。肝脏的细胞死亡主要是通过细胞凋亡或坏死来实现的。
近年来,几种不同形式的程序性细胞死亡(PCD)被定义为具有独特的细胞机制,其中铁死亡是一种非凋亡性的调节性细胞死亡形式,越来越受到人们的关注。铁死亡是由膜磷脂的多不饱和脂肪酰基(PUFA)部分氧化产生的过氧化磷脂过量积累引起的,并由铁依赖机制催化。作为一种病理性细胞死亡,铁死亡被认为是一种与氧化应激相关的疾病,包括缺血/再灌注损伤和神经退行性疾病。
图片来源:
https://doi.org/10.1038/s41418-022-00957-6
近日,上海交通大学研究者们在Cell Death &
Differentiation杂志上发表了题为“Ubiquitin ligase E3 HUWE1/MULE
targets transferrin receptor for degradation and suppresses ferroptosis in
acute liver injury”的文章。该研究证明了HUWE1是一种潜在的保护因子,可以同时拮抗异常铁蓄积和铁死亡,从而减轻急性肝损伤。这些发现可能为高表达HUWE1等位基因的患者提供临床意义。
含有Hect结构域的泛素E3连接酶HUWE1(也称为MULE)最初被证明可以促进细胞凋亡。然而,研究者的初步研究表明,HUWE1在供肝患者中的高表达与患者肝移植后较小的损伤和较好的肝功能相关。因此,研究者研究了HUWE1在急性肝损伤中的作用,并通过转铁蛋白受体1(TfR1)确定HUWE1是一种负性铁死亡调节剂。
小鼠肝细胞(HKO)中HUWE1的缺失加重了I/R和CCl4诱导的肝损伤,并导致更多的铁死亡。此外,抑制HUWE1显著增强了原代肝细胞和小鼠胚胎成纤维细胞对铁死亡的敏感性。在机制上,HUWE1针对TfR1进行泛素化和蛋白酶体降解,从而调节铁的代谢。重要的是,TfR1的化学和遗传抑制显著减少了HUWE1KO细胞和HUWE1HKO的铁死亡。
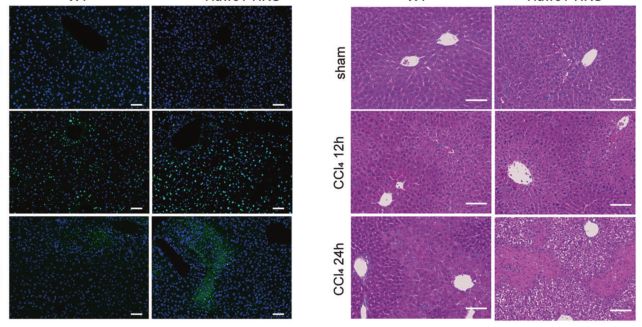
肝细胞内HUWE1的缺失加剧了小鼠的急性肝损伤
图片来源:
https://doi.org/10.1038/s41418-022-00957-6
综上所述,研究者发现HUWE1是一种新的急性肝损伤中铁死亡的抑制因子。HUWE1针对TfR1进行泛素化和降解,以调节铁的新陈代谢,从而调节铁死亡。该研究为靶向HUWE1-TfR1轴作为临床干预包括I/R在内的急性肝损伤的一种新策略提供了实验证据。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



