自闭症社交障碍有破解之法?Nat Commun:大脑里的“社交激素”通路断了,激活受体就能修复
来源:生物谷原创 2025-09-25 14:36
这项研究让自闭症治疗从 “广谱尝试” 向 “精准打击” 迈出了关键一步。
自闭症谱系障碍(ASD)最核心的困扰,莫过于社交互动的 “鸿沟”—— 孩子可能不愿与人对视、不懂回应问候,成人或许难以维系关系、解读情绪。多年来,Shank3 基因一直被视作自闭症的 “嫌疑基因”,但它究竟如何搅乱大脑的社交齿轮,始终是个谜。
近日,发表在《Nature Communications》上的一项研究终于破解了这个难题:来自西班牙、中国等多国的团队发现,Shank3 基因突变会切断大脑中 “社交激素” 血管加压素(AVP)的关键通路,而只要精准激活外侧隔核(LS)里的两种特定受体,就能分别修复社交能力或调节攻击性,且不会引发副作用。这一发现,为自闭症精准治疗打开了全新大门。

故事要从大脑里的 “社交调控中心” 说起。外侧隔核(LS)是边缘系统的关键枢纽,负责调控社交探索、领地防御等多种社会行为,而血管加压素就是这里的 “指挥信号”。研究团队首先把目光投向了 Shank3B⁺/⁻雄性小鼠——这类小鼠因携带自闭症相关突变,天生就有社交缺陷:在社交偏好测试中,它们不会像正常小鼠那样主动靠近装有同类的杯子;在 “常驻者-入侵者实验” 里,它们也很少表现出雄性小鼠典型的领地攻击性,甚至连主动探索同类的欲望都大幅降低。
深入追踪后,团队发现了问题的根源:小鼠大脑中分泌血管加压素的神经元 “断了线”。正常情况下,终纹床核(BNST)的血管加压素神经元会像 “电线” 一样延伸到外侧隔核,持续释放信号调控社交行为;但 Shank3B⁺/⁻小鼠的 BNST 中,血管加压素阳性细胞数量减少,延伸到外侧隔核的纤维密度也显著降低,导致外侧隔核接收的 “社交信号” 几乎断供。更关键的是,这种损伤并非全身性的——下丘脑等其他脑区的血管加压素系统完好无损,说明问题精准出在 “BNST-外侧隔核” 这条特定通路上。
为什么会出现这种精准损伤?进一步研究揭开了谜底。Shank3 基因编码的蛋白是突触后膜的 “支架”,负责维持兴奋性突触的正常功能。Shank3 突变后,BNST 中血管加压素神经元表面的谷氨酸能突触(由 VGLUT1 标记)数量变少、体积变小,相当于给这些神经元 “断了电”,最终导致它们无法正常发育和传递信号。就像信号灯的供电线路出了故障,即使信号灯本身没坏,也无法指引交通。
最令人振奋的发现,藏在血管加压素的 “双受体调控系统” 里。研究团队发现,血管加压素在外侧隔核里并非 “一刀切” 地调控所有社交行为,而是通过两种受体分工合作:AVPR1a 受体专门负责 “社交能力”,AVPR1b 受体则专注于 “社交攻击性”。在正常小鼠中,阻断 AVPR1a 会让它们立刻失去社交偏好,对同类和空杯子毫无差别;而阻断 AVPR1b,雄性小鼠的领地攻击性会大幅下降,但社交探索不受影响。这种各司其职的特性,恰好为精准治疗提供了可能。
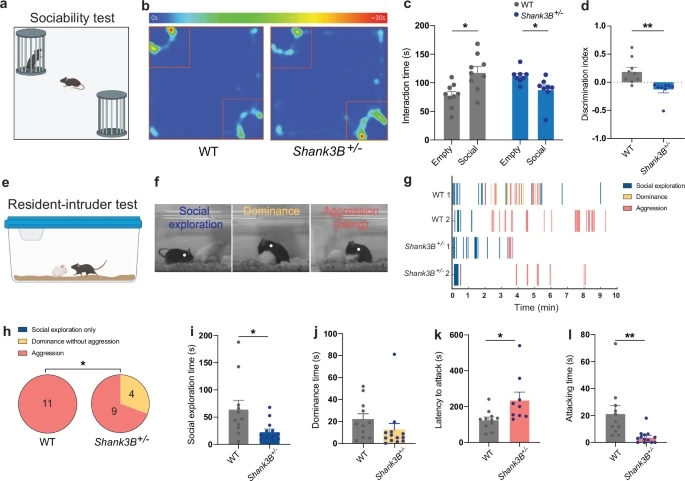
针对 Shank3B⁺/⁻小鼠的实验更是印证了这一点。研究人员给突变小鼠的外侧隔核注射药物:用 “AVP+AVPR1b 拮抗剂” 的组合激活 AVPR1a 时,小鼠立刻恢复了社交偏好,会主动靠近同类;而注射 AVPR1b 激动剂 DDAVP 时,它们的领地攻击性得到了调节,却不会影响社交能力。更重要的是,这种修复是 “精准无副作用” 的 —— 不会像非特异性药物那样,改善社交的同时引发过度攻击,这正是临床治疗最渴求的特质。
为了实时验证这一机制,团队还用上了 “黑科技”——与北京大学李毓龙实验室合作开发的新型血管加压素生物传感器 AVP0.3。这个工具能像 “实时摄像头” 一样捕捉大脑中的血管加压素释放。实验清晰显示:正常小鼠在社交探索或发起攻击时,外侧隔核的血管加压素会瞬间飙升;而 Shank3B⁺/⁻小鼠在这些场景下,血管加压素释放几乎没有波动。结合光纤 光度测量技术,团队还发现,BNST 到外侧隔核的血管加压素纤维在社交和攻击行为中会被特异性激活,且攻击时的激活强度更高。
值得注意的是,这项研究聚焦于雄性小鼠,这背后藏着重要的性别差异线索。血管加压素系统在雄性哺乳动物中更为发达,BNST 到外侧隔核的血管加压素纤维密度远高于雌性,这或许能部分解释为什么自闭症在男性中发病率更高——或许女性大脑中存在其他代偿通路,或社交缺陷表现得更为隐蔽。研究团队表示,未来将进一步探索雌性小鼠的相关机制,为个性化治疗提供依据。
目前,这项研究成果已提交专利申请,目标是开发能选择性激活 AVPR1a 受体的药物。相比于此前临床试验中效果有限的非特异性药物,这种精准靶向疗法能直击自闭症社交缺陷的核心,且不会引发攻击性等副作用。更重要的是,它为理解自闭症的 “异质性” 提供了新视角——不同患者的社交障碍或许源于不同的受体通路异常,未来有望通过 “精准分型+靶向用药” 实现个性化治疗。
从发现基因突变到破解神经机制,再到找到精准靶点,这项研究让自闭症治疗从 “广谱尝试” 向 “精准打击” 迈出了关键一步。或许在不久的将来,自闭症患者不必再困于社交的 “无形墙” 后,只需一次精准的受体激活,就能顺畅地连接世界。(生物谷Bioon.com)
参考文献:
Maria Helena Bortolozzo-Gleich et al, Impaired vasopressin neuromodulation of the lateral septum leads to social behavior deficits in Shank3B+/- male mice, Nature Communications (2025). DOI: 10.1038/s41467-025-61994-6.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


