PNAS:刘凯组发现lipin1敲减协调神经元信号通路促进脊髓损伤后轴突再生
来源:生物探索 2024-10-12 10:08
研究表明,抑制lipin1表达不仅改变神经元内脂类代谢,而且通过PA和LPA来激活mTOR和STAT3信号通路,从而决定CNS轴突再生能力。
2019年,香港科技大学刘凯课题组在Neuron上发表长文Rewiring neuronal glycerolipid metabolism determines the extent of axon regeneration,发现通过调节神经元的甘油脂代谢,使神经元中参与细胞膜构造的磷脂类合成增加,而贮藏脂类如甘油三酯合成减少,能够促进损伤后的视神经轴突再生【1】。然而,是否有更多的分子机制参与其中以及相关机制在脊髓损伤后的作用尚待研究。
近日,刘凯课题组在PNAS发表文章Lipin1 depletion coordinates neuronal signaling pathways to promote motor and sensory axon regeneration after spinal cord injury,进一步阐释了lipin1通过调控神经元内脂质分子来影响关键的信号通路,进而决定脊髓损伤后皮质脊髓束(CST)和上行感觉神经的轴突再生。

Lipin1是一种磷脂酸磷脂酶,在细胞从头合成甘油三酯的甘油三磷酸途径中发挥重要作用。之前的研究发现,抑制视神经节细胞(RGC)中lipin1表达能够重塑神经元的脂类代谢,使其从合成贮藏性脂类如甘油三酯转向合成细胞膜组分的磷脂,从而提升视神经的再生能力【1】。然而,脂质分子除了用于储存能量和组成细胞膜,也是重要的信号传导分子。Lipin1的底物磷脂酸(PA)及其上游的溶血磷脂酸(LPA)就是典型的例子。PA可以直接与mTOR结合以调控其与底物的结合和催化能力,而LPA也参与多种信号通路的激活【2-3】。为了研究lipin1是否通过脂质分子信号传递影响轴突再生,研究者检测lipin1敲减(KD)激活哪些与轴突再生相关的信号通路。
研究发现,lipin1 KD激活mTOR和STAT3。如果敲除mTOR或者Stat3,lipin1 KD诱导的视神经再生被部分抑制。mTOR主要通过mTORC1决定CNS再生能力。敲除mTORC1的骨架蛋白Rptor与敲除mTOR有相似的抑制再生效果。有意思的是,同时敲除Rptor和Stat3完全消除了lipin1 KD促使的视神经再生。这说明lipin1主要通过mTOR和STAT3信号通路影响视神经再生。
下一步,研究者探究PA和LPA是否介导了lipin1对mTOR和STAT3的调控。研究发现,lipin1 KD后神经元内PA和LPA的丰度增加。直接将PA递送到体外培养的神经元能激活mTOR,但无法激活STAT3。递送LPA则同时激活了mTOR和STAT3。更重要的是,递送PA或者LPA均能促进神经轴突的生长。这说明lipin1通过改变神经元内PA和LPA的丰度来调控mTOR和STAT3活性。
由于视神经损伤后lipin1上调滞后于mTOR的下调,研究者进一步探索mTOR是否影响lipin1的表达。研究发现,mTOR抑制lipin1的表达,过表达lipin1抑制mTOR的激活,而且过表达lipin1抑制了Pten敲除促使的视神经再生。结合之前的结果,研究发现mTOR–lipin1-PA/LPA–mTOR形成了一条正反馈信号环路,这可能是CNS神经损伤后mTOR被持续抑制的关键机制。
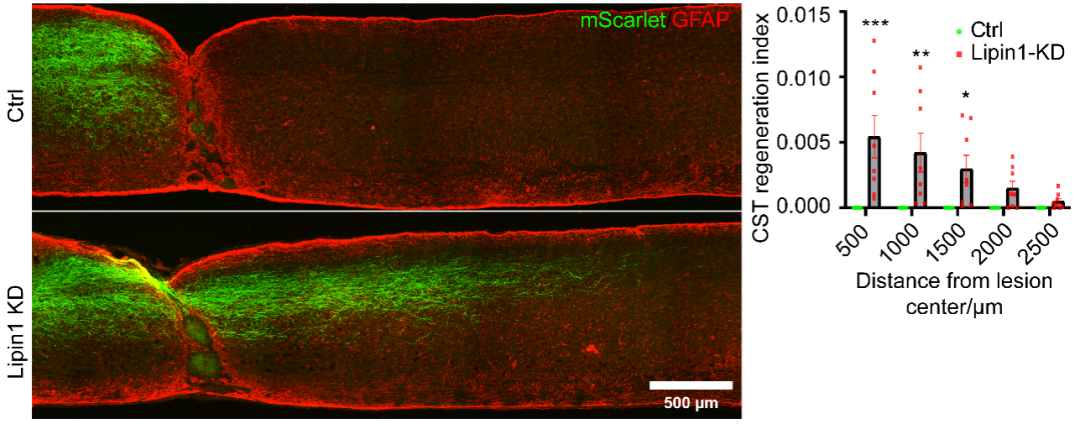
图 1 Lipin1 KD促进完全脊髓损伤后CST再生(Credit: PNAS)
前面的研究主要以视神经损伤为模型。进一步的,研究者探索lipin1能否调控脊髓损伤后的轴突再生。研究者首先关注从大脑皮层投射到脊髓的CST的再生能力。研究发现:在脑干切断单侧锥体以清除一束CST的模型,lipin1 KD促使CST形成更多的分支投射到对侧;在脊髓完全横断损伤模型,lipin1 KD促使CST轴突茁壮再生,穿越损伤区并投射到远端区域(图1)。为了确定lipin1 KD在其他脊髓束再生中是否也起作用,研究者测试了上行的感觉神经的再生。研究发现,lipin1 KD也显著增强了感觉神经的再生能力。有趣的是,lipin1 KD激活了mTOR但不激活STAT3,这说明不同神经元的脂质代谢或者信号传递可能存在差异。
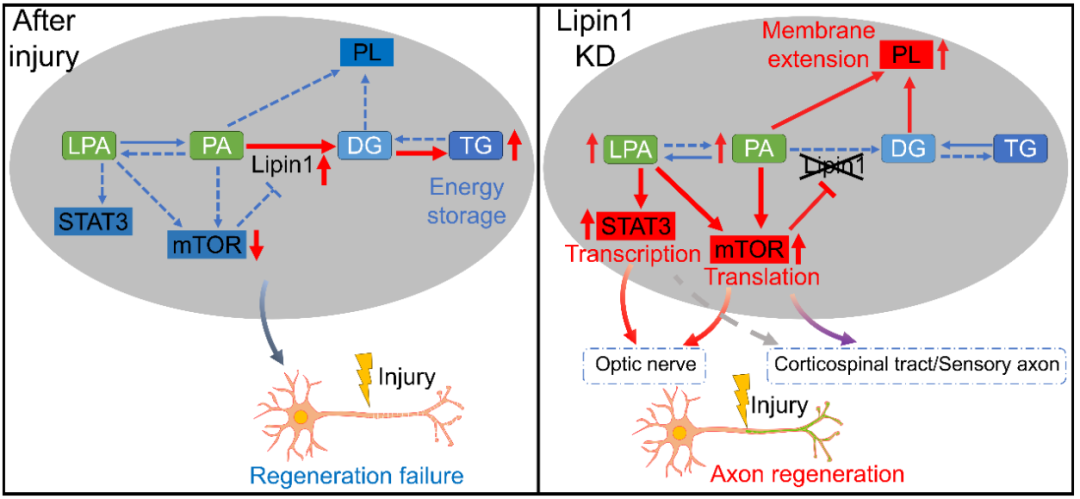
图 2 Lipin1调控轴突再生的分子机制(Credit: PNAS)
综上所述,抑制lipin1表达不仅改变神经元内脂类代谢,而且通过PA和LPA来激活mTOR和STAT3信号通路,从而决定CNS轴突再生能力(图2)。这一研究确定了lipin1作为控制多种轴突再生的保守性靶标,为修复脊髓损伤提供了新的方向。
参考文献
1. C. Yang et al., ‘Rewiring Neuronal Glycerolipid Metabolism Determines the Extent of Axon Regeneration’, Neuron, vol. 105, no. 2, pp. 276-292.e5, Jan. 2020, doi: 10.1016/j.neuron.2019.10.009.
2. M. A. Frias, A. Hatipoglu, and D. A. Foster, ‘Regulation of mTOR by phosphatidic acid’, Trends in Endocrinology & Metabolism, vol. 34, no. 3, pp. 170–180, Mar. 2023, doi: 10.1016/j.tem.2023.01.004.
[3] L. H. M. Geraldo et al., ‘Role of lysophosphatidic acid and its receptors in health and disease: novel therapeutic strategies’, Sig Transduct Target Ther, vol. 6, no. 1, p. 45, Feb. 2021, doi: 10.1038/s41392-020-00367-5.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


