干细胞移植治疗阿尔茨海默病,可减少Aβ淀粉样斑块,预防认知障碍,计划探索人体试验
来源:生辉 2023-08-17 11:26
干细胞具有自我更新和多向分化等多种潜能,是神经再生和神经修复的理想细胞来源之一。近年来,干细胞治疗已经成为难治性神经系统疾病一个极具前景的治疗新方向,且已取得了许多重要突破。
干细胞具有自我更新和多向分化等多种潜能,是神经再生和神经修复的理想细胞来源之一。近年来,干细胞治疗已经成为难治性神经系统疾病一个极具前景的治疗新方向,且已取得了许多重要突破。
近日,加州大学圣地亚哥分校的科学家们利用干细胞疗法缓解了阿尔茨海默病小鼠的症状。在概念验证试验中,研究团队将野生型造血干/祖细胞(WT HSPC)单次系统注射到 5xFAD 小鼠,这些移植的干细胞可以有效预防或者缓解阿尔茨海默病小鼠模型中的多种体征和症状。相关研究已经发表在 Cell Reports 上。
与阿尔茨海默病小鼠相比,接受健康造血干/祖细胞移植的小鼠可以预防记忆丧失和神经认知障碍,并显著减少海马体和皮质中的 Aβ 淀粉样斑块,以及降低神经炎症。
5XFAD 小鼠是同时表达五个家族性 AD 突变基因的 APP/PS1 双转基因小鼠模型,这种小鼠重现了 AD 淀粉样蛋白病理的主要特征,可作为神经元内 Aβ-42 诱导的神经变性和淀粉样斑块形成的模型。
(来源:Cell Reports)
本文的主要作者是 Priyanka Mishra 和 Alexander Silva,通讯作者是 Stephanie Cherqui。Stephanie Cherqui 是加州大学圣地亚哥分校 (UCSD) 的儿科教授、胱氨酸病干细胞和基因治疗联盟的主席。她实验室专注于开发针对包括胱氨酸病在内的退行性多系统疾病的干细胞和基因疗法,并了解造血干细胞子代导致非造血遗传性疾病组织修复的分子机制。
“阿尔茨海默病是一种非常复杂的疾病,也因此任何潜在的治疗方法都必须能够针对多种生物途径。我们的工作表明,造血干细胞和祖细胞移植有潜力预防阿尔茨海默病的并发症,并且可能成为一种治疗这种疾病极具前景的方法。”Stephanie Cherqui 说。

(来源:France-Science)
移植干细胞疗法,可预防、缓解阿尔茨海默病症状
根据新闻稿中的描述,研究中干细胞移植治疗成功缓解 AD 症状主要可以归结为这种疗法对小胶质细胞的影响。
小胶质细胞是一类位于大脑和脊髓中的巨噬细胞,负责中枢神经系统(CNS)的免疫防御。研究显示,小胶质细胞的病变影响阿尔茨海默病的发生和发展。在健康状态下,小胶质细胞可以清除 Aβ 淀粉样斑块,然而在 AD 状态中由于小胶质细胞相关基因 P2ry12、Apoe 和 Trem2 等的突变,这一功能会受到损伤。
进一步讲,小胶质细胞持续的炎症已经被确定为一个 AD 发病机制的因素,炎症细胞因子、趋化因子和补体蛋白的释放会增加 Aβ 斑块的产生。这些 Aβ 淀粉样蛋白积聚还会给其他脑细胞带来压力,影响大脑血流的内皮细胞。
也因此,靶向小胶质细胞被研究团队视为是 AD 治疗的一种潜在策略。Stephanie Cherqui 研究团队在这一领域已经进行了大量工作,此前该团队已经通过试验证明单次系统移植野生型造血干细胞和祖细胞(HSPC)可以持久缓解胱氨酸病和弗里德赖希共济失调小鼠的疾病症状和进展。
在弗里德赖希共济失调小鼠模型中,移植的 HSPC 植入并分化为大脑和脊髓中的小胶质细胞,以及背根神经节(DRG)中的巨噬细胞,从而保护了神经元及其运动功能;此前,通过骨髓干细胞移植有效替代中枢神经系统中的小胶质细胞。
先前的这些研究进一步表明小胶质细胞在 AD 中扮演的重要角色。在这些研究工作基础之上,该团队尝试探索利用 WT HSPC 移植是否可以在脑部生成新的健康小胶质细胞,从而减缓 AD 症状和进展。
在最新的试验中,研究团队将健康的野生型造血干细胞和祖细胞移植到成年 5xFAD 小鼠中,其中 2-4 个月 5xFAD 小鼠的海马体和皮质中可观察到 Aβ 斑块沉积,3-6个月 5xFAD 小鼠表现出明显的神经认知障碍和焦虑行为改变。这些小鼠还表现出 AD 淀粉样斑块病理学的主要特征,包括小胶质细胞的增生和激活。
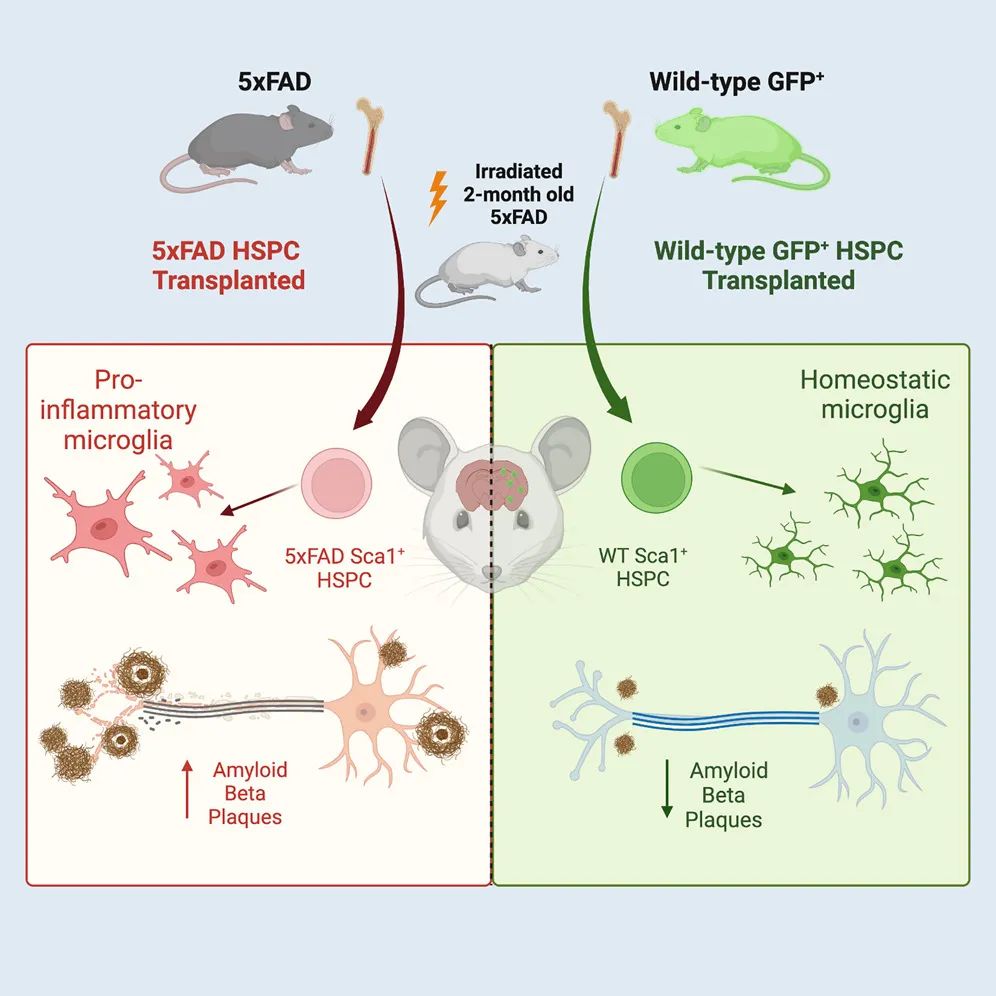
(来源:Cell Reports)
试验证明,单次全身 WT HSPC 移植到成年 5xFAD 小鼠中可以预防小鼠的记忆丧失和神经认知功能障碍。与未经过治疗的 AD 小鼠相比,这些小鼠能更好识别物体和感知风险,以及保持正常的焦虑水平和运动活动。且野生型和 5xFAD 的 HSPC 均分化为小胶质细胞样细胞,不过,只有移植 WT HSPC 可以明显减少海马体和皮质中的 Aβ 斑块、小胶质细胞增生以及神经炎症,并保持了血脑屏障的完整性。
接下来,研究人员通过转录组分析比较了经过治疗和未治疗的阿尔茨海默病小鼠中不同基因的表达。数据显示,接受干细胞移植的小鼠皮质中与患病小胶质细胞相关的基因表达较少,海马体中与神经变性相关内皮细胞相关的基因表达也较少。
此外,研究人员还发现,接受从阿尔茨海默病小鼠中分离出的干细胞移植的第三组小鼠没有表现出任何改善迹象,这些细胞保留了阿尔茨海默病的相关信息。
“整体而言,移植健康的造血干细胞和祖细胞可以增强小胶质细胞的健康状态,从而预防多种程度的阿尔茨海默病病理症状。”
已申请相关专利,计划探索人体试验
论文中提到,WT HSPC 移植减少了 Aβ 积累,并预防了小胶质细胞增生、神经炎症和脉管系统损伤,这些在预防 AD 神经认知衰退方面都发挥着至关重要的作用。我们的探究为使用 HSPC 移植作为无法治疗疾病的治疗靶点提供了概念证明。这项工作表明 HSPC 移植具有预防 AD 相关并发症的潜力,是非常有前景的一种治疗手段。
根据官方新闻稿,这项工作已经包含在了题为“治疗阿尔茨海默病的方法”(#114198-8190) 的专利中,研究人员已经为这种治疗方法申请了相关专利。
该研究团队表示,接下来将会进一步探讨移植健康干细胞产生明显改善效果的具体作用机制,以及探索这种类似的移植策略是否可以用于缓解人类的阿尔茨海默病。
值得一提的是,研究团队也可能基于 Stephanie Cherqui 联合创办的初创公司 Papillon Therapeutics 推进这项研究工作。这是一家针对遗传性疾病开发治疗方法的生物技术公司,利用经过临床和商业验证的方法来移植和制造基因修饰的造血干细胞和祖细胞(HSPC),该公司的技术已经获得了加州大学圣地亚哥分校的独家许可。
现阶段,该公司进展最快的是针对胱氨酸病(一种溶酶体贮积病)的管线PPL-001,这是一种基因修饰的造血干细胞和祖细胞(HSPC)疗法,旨在纠正弗里德赖希共济失调患者 FXN 基因中的致病突变。接受基因修饰 HSPC 治疗的患者会经历 HSPC 活化和收集的标准程序,然后进行基因修饰、细胞处理,最后再输注。该公司已经完成了该管线的 1/2 期临床试验,并报告了积极的结果。
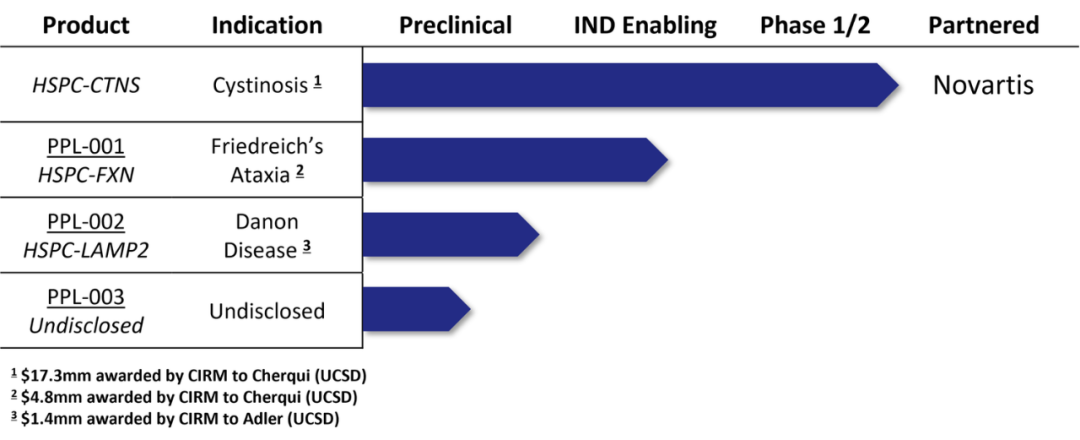
▲图 | 在研管线(来源:Papillon Therapeutics 官网)
科学创始人 Stephanie Cherqui 对细胞通讯和交叉校正理解的最新进展为公司基因修饰 HSPC 治疗的作用机制提供了基础。Stephanie Cherqui 发表的研究表明,“受损组织的功能性修复与通过巨噬细胞和小胶质细胞的物理投射转移生物载荷相关。基因治疗的常见方法依赖于病毒将可溶性蛋白质有效载荷递送至特定组织,而我们的方法可以将任何细胞货物(包括不溶性蛋白质和整个细胞器)递送至任何组织器官。”
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



