Nature全文编译!揭示新冠病毒刺突蛋白在完整病毒颗粒上的结构和分布
来源:本站原创 2020-08-23 12:19
2020年8月23日讯/生物谷BIOON/---新型冠状病毒SARS-CoV-2属于β冠状病毒属,是一种包膜病毒,含有较大的由核衣壳蛋白(N)包裹的正义RNA基因组。三个跨膜蛋白被整入病毒脂质包膜:刺突蛋白(S)和两个较小的蛋白,即膜蛋白(M)和包膜蛋白(E)。当通过低温电镜(cryo-EM)成像时,β冠状病毒呈近似球形颗粒,直径在100纳米上下浮动,内含致
2020年8月23日讯/生物谷BIOON/---新型冠状病毒SARS-CoV-2属于β冠状病毒属,是一种包膜病毒,含有较大的由核衣壳蛋白(N)包裹的正义RNA基因组。三个跨膜蛋白被整入病毒脂质包膜:刺突蛋白(S)和两个较小的蛋白,即膜蛋白(M)和包膜蛋白(E)。当通过低温电镜(cryo-EM)成像时,β冠状病毒呈近似球形颗粒,直径在100纳米上下浮动,内含致密的病毒质(viroplasm),由突脂质双层包围着,S蛋白三聚体(下称S三聚体)从脂质双层中突出。SARS-CoV-2的S三聚体结合到靶细胞表面上的受体ACE2,并介导随后的病毒摄取和融合。在这样做的过程中,S蛋白经历了显著的结构重排,从融合前的构象切换到融合后的构象。S蛋白融合前和融合后的整体结构在冠状病毒中是非常保守的。
在感染过程中,冠状病毒广泛地重塑细胞的内部膜结构,产生病毒复制细胞器以便在其中进行病毒复制。S蛋白,连同蛋白M和E,被插入到内质网(ER)的膜中,并被运送到内质网-高尔基体中间区室(ER Golgi intermediate compartment, ERGIC)。封装的基因组出芽到ERGIC中以形成病毒颗粒,随后将病毒颗粒运送到质膜并释放出去。S蛋白是通过先在S1/S2位点随后在S2'位点进行蛋白酶切割,从而为膜融合做好准备。
包括SARS-CoV-2在内的冠状病毒的S蛋白融合前结构已通过可溶性的分泌形式的S蛋白异位表达,随后进行纯化和cryo-EM成像,得到了广泛研究。在S蛋白融合前结构中,受体结合结构域(RBD)位于融合核心(fusion core)上方的一个较宽的S三聚体刺突结构的顶部。在含有三个RBD的S三聚体中,每个RBD被一个显示出一定流动性的N端结构域(NTD)包围着。在封闭的融合前结构中,所有三个RBD平铺在刺突结构表面上,在很大程度上封闭了受体结合位点,而在开放的融合前结构中,一个或多个RBD向上抬起,从而暴露受体结合位点。S三聚体的表面发生广泛的糖基化,每个S蛋白单体有22个潜在的N-糖基化位点。在结合受体ACE2后,从融合前到融合后的结构转变让S蛋白的融合肽和跨膜结构域聚集在一个以三螺旋束为中心的长针状结构的一端。五个N连接的聚糖沿融合后的S三聚体刺突结构的长度间隔分布。
充分理解S蛋白如何发挥作用,以及它们如何与免疫系统相互作用,需要了解病毒颗粒内S三聚体的结构、构象和分布。在一项新的研究中,来自英国医学研究理事会分子生物学实验室和德国海德堡大学的研究人员利用cryo-EM方法研究了S三聚体在病毒颗粒表面上的结构、构象和分布。相关研究结果于2020年8月17日在线发表在Nature期刊上,论文标题为“Structures and distributions of SARS-CoV-2 spike proteins on intact virions”。
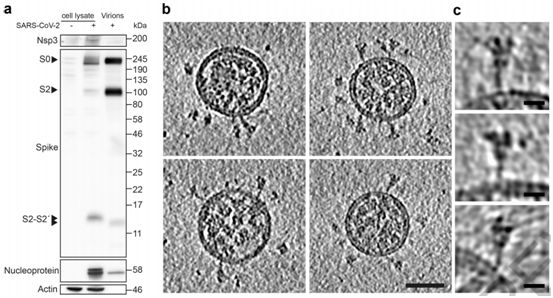
为了避免与病毒浓缩或纯化相关的伪影(artefacts),这些作者想要在不浓缩或纯化病毒的情形下对来自感染细胞的上清液的SARS-CoV-2病毒进行成像。利用SARS-CoV-2(病毒分离株Germany/BavPat1/2020)感染VeroE6细胞。在感染48小时后,上清液经澄清后用甲醛固定灭活,并在-80℃下储存。蛋白印迹法(Western blot)显示,病毒颗粒上大约45%的S蛋白单体在多精氨酸切割位点上切割成S1和S2(图1a)。固定的上清液通过骤冻玻璃化,并通过cryo-EM成像。固定可能有助于通过交联让一些蛋白构象稳定化,但预计不会产生任何新的构象。正如预期的那样,考虑到细胞上清液中病毒的浓度(约107个噬菌斑形成单位/ml, PFU/ml),他们发现少量的病毒颗粒分散在网格周围---这些病毒颗粒通过低温电子断层扫描(cryo-electron tomography, cryo-ET)成像(图1b)。
SARS-CoV-2病毒颗粒是近似球形的,到脂质双层外边缘的直径为91±11纳米(n = 179)。它们含有与N蛋白相对应的颗粒状密度,并缀有S三聚体(图1b,c)。这些特征与利用cryo-EM成像的其他冠状病毒的特征基本一致。从这种病毒表面上突出的S三聚体有两种形态--少数是延长的薄结构,这让人联想到融合后的构象,而大多数是更宽的结构,这让人联想到融合前的构象。这一观察结果与近期在预印本服务器上发表的一份论文(bioRxiv, 2020, doi:10.1101/2020.03.02.972927)---该论文显示了用核酸修饰剂β-丙内酯灭活的纯化SARS-CoV-2病毒的cryo-EM图像,在该图像中仅在病毒表面上观察到薄薄的突起---形成了鲜明的对比,但与原位观察到的病毒组装相一致。
这些作者还收集了SARS-CoV-2感染CALU-3细胞后产生的病毒颗粒的断层扫描图,其中Calu-3细胞是一种人肺癌细胞系,在病毒感染上产生的病毒滴度与VeroE6细胞相当。CALU-3细胞产生的这些病毒颗粒的形态和S三聚体在病毒颗粒表面上的外观与从VeroE6细胞产生的病毒颗粒所观察到的相一致。蛋白印迹分析表明,约73%的S蛋白为裂解形式。
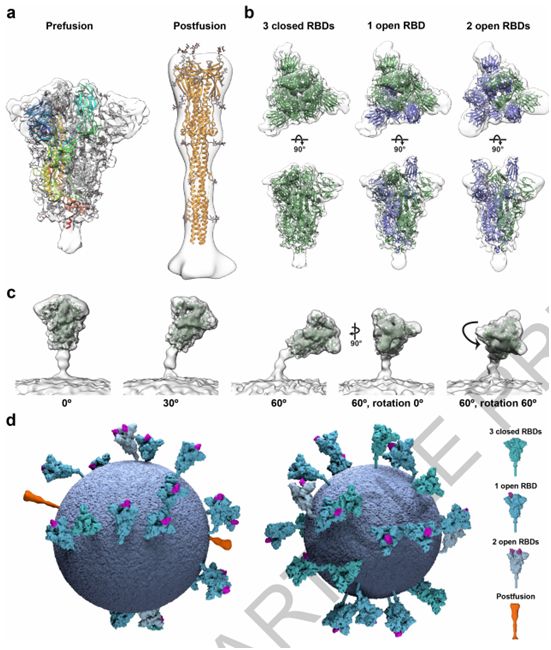
SARS-CoV-2病毒颗粒含有24±9个S三聚体。这个值低于之前假设S蛋白等距离分布的估计值,这是因为S蛋白在病毒表面分布不均匀。一小群病毒颗粒仅含有很少的S三聚体,而较大的病毒颗粒则含有更多的S三聚体。这些作者从179个病毒颗粒中鉴定出4104个宽的S三聚体和116个薄的S三聚体,并对它们进行子断层扫描图平均化(subtomogram averaging)。平均化的结构,在7.7和22埃的分辨率下,分别非常好地对应于之前公布的纯化S三聚体在融合前和融合后形式下的结构(图2a)。总体而言,约97%的S三聚体是融合前形式,3%是融合后形式。融合前和融合后的S三聚体形式似乎是均匀地分布在病毒颗粒中。
病毒表面上的融合前S三聚体可能主要处于封闭构象,它的开放构象可通过ACE2结合诱导或稳定化,或者它在融合前也可能存在开放构象。当用作免疫原时,开放或封闭的构象可诱导不同范围的抗体,目前人们正在努力产生稳定在其中一种构象的S蛋白构造体。
为了评估S三聚体是否存在于开放和/或封闭的构象,这些作者对S三聚体中的S蛋白单体的RBD区域进行分类。他们发现三种类型:RBD处于封闭位置的S蛋白;RBD处于开放位置的S蛋白;RBD以封闭位置为主但密度有所减弱的S蛋白,这表明存在更多的可移动构象。
考虑到每个S蛋白单体被分配到的类型,这些作者推导出完全封闭的S三聚体结构,以及其中一个RBD是开放的S三聚体结构,这两者分别代表了3854个融合前S三聚体中的约31%和约55%(图2b)。他们还发现了少量S三聚体(3854个融合前S三聚体中的约14%)的两个RBD处于开放构象(图2b)。这些观察结果证实在重组S三聚体中观察到的RBD的开放也发生在病毒表面上,并且稳定在封闭和开放构象中的人工S蛋白构造体都代表了原位存在的结构。因此,这种受体结合位点在原位随机暴露,并可与ACE2以及与抗体相互作用。
这些S三聚体并不都是直接从病毒表面突出来的。它们可以向膜倾斜90°,尽管倾斜超过50°就不那么有利。这些作者根据S三聚体相对于膜的方向对它们进行分组,并且分别对每组进行平均化。这些平均化的结构表明膜近端茎区域作为一个铰链有足够的灵活性,允许向各个方向倾斜(图2c)。
这些作者构建出SARS-CoV-2病毒颗粒的模型,在该模型中,S三聚体的位置、方向和构象是通过子断层扫描图平均化确定的(图2d)。S三聚体似乎是随机分布在病毒表面上,它们的位置、方向和构象之间没有明显的聚类或关系。在SARS-CoV-2中,每1000 平方纳米膜表面大约有一个S三聚体,相比之下,在甲型流感病毒中,每100平方纳米膜表面大约有一个S三聚体。在SARS-CoV-2中,S蛋白的稀疏分布以及它们主要处于封闭状态意味着与大流行性流感病毒相比,受体结合可能较少依赖于亲和效应。这与S蛋白和ACE2之间的亲和力(在nM范围内)比血凝素和唾液酸之间的亲和力(mM范围)高相一致。
上清液中低浓度的病毒颗粒使得解析出高分辨率的结构变得困难。因此,这些作者通过蔗糖垫层离心沉淀法对这些病毒颗粒进行浓缩。浓缩的病毒颗粒偏离球形形态,但是它们的整体特征仍保留下来。他们对这些病毒颗粒进行了cryo-ET成像和子断层扫描图平均化,观察到的主要是融合前S三聚体,偶尔有融合后S三聚体。在对融合前S蛋白进行分类后,他们只能识别出处于封闭位置的RBD,以及观察到RBD密度较弱的S蛋白单体。
从感染细胞的上清液中的病毒颗粒主要显示融合前S三聚体,这些S三聚体处于封闭或开放的融合前构象。通过蔗糖垫层离心法浓缩的病毒颗粒继续呈现融合前构象,但不再观察到开放构象。其他研究已表明,用β-丙内酯,而不是甲醛灭活的病毒颗粒主要处于融合后状态。从膜中纯化的S三聚体仅处于封闭的融合前构象和融合后构象,而其他研究已提示着可溶性S三聚体中的开放RBD是在一系列连续不同的位置中发现的。这些观察表明这些作者在浓缩之前而不是浓缩之后观察到的S蛋白的开放融合前构象是脆弱的(尽管文中进行了固定),并可能受到纯化过程的影响。
这些作者的数据提示着灭活和纯化方法可以改变融合前和融合后形式的比例,以及开放和封闭形式的比例。据推测,病毒表面上大量的融合后S蛋白可能通过屏蔽融合前形式保护这种病毒,或者可能将宿主反应转向非中和抗体。鉴于在完整的病毒颗粒上观察到小一部分融合后S三聚体刺突结构,这些作者认为这不太可能是病毒在感染过程中的重要防御机制,但它可能是疫苗接种的一个重要考虑因素。基于灭活病毒颗粒的候选疫苗正在开发中。根据不同的制备方式,这些疫苗可能会向免疫系统呈现不同的S蛋白表位,因此它们诱导中和反应的能力也不同。比如,β-丙内酯经常用于疫苗生产(如用于流感病毒亚单位疫苗),但如果融合后S三聚体诱导非中和反应,那么β-丙内酯可能不是SARS-CoV-2病毒S蛋白疫苗配方制备期间用于病毒灭活的最佳选择。
接下来,这些作者利用cryo-EM对浓缩的SARS-CoV-2病毒进行二维成像,并对那些从病毒颗粒侧面突出的融合前S三聚体进行单颗粒分析,从而产生3.4埃分辨率的融合前S三聚体共识结构。对RBD单体进行集中分类和部分信号减法,可将它们分为两类。与通过cryo-ET发现样品中不存在开放构象相一致的是,这些作者观察到81%的S蛋白单体中RBD处于封闭构象,19%的S蛋白单体中RBD的密度较弱,但主要处于封闭位置。他们将所有三个RBD都处于封闭构象的S三聚体(53%的数据)以及至少一个RBD的密度减弱的S三聚体(47%的数据)的结构分别优化到3.5埃和4.1埃的分辨率(图3a)。这两种结构高度相似,仅在一个RBD的密度水平上有所不同。他们利用这种具有三个封闭RBD的结构,建立并完善了S三聚体在病毒表面原位的原子模型。
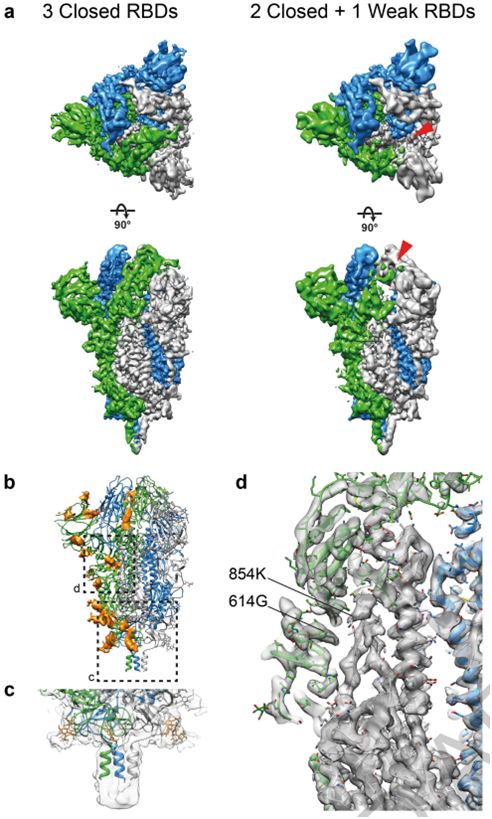
在这些作者建立的结构中,S蛋白表面上的聚糖位置得到了很好的解决:在22个预测的N-糖基化位点中,有17个存在密度(图3b)。其他5个糖基化位点位于无序的NTD环或茎区域,并没有在高分辨率下解决。在S三聚体的底部,一个清晰的聚糖环在茎区域上形成一个项圈。相比于已公布的可溶性胞外结构域结构,茎区域的密度延伸了2个螺旋转弯(helical turn)并在更低的分辨率下进一步延长,直到由于茎区域的灵活性而逐渐消失(图3c)。SARS-CoV-2的S三聚体分布稀疏,可以高度向膜倾斜。这意味着,在头部区域基部和茎区域的抗原表位将被抗体接触到,在那里它们得不到聚糖壳的广泛保护。
这些作者比较了S三聚体的原位结构和以前使用外源表达的纯化蛋白获得的结构。最近的一项针对溶于去污剂胶团的全长S三聚体的研究确定了在可溶性S蛋白胞外结构域三聚体的大多数结构中没有观察到的两个特征:S蛋白的氨基酸残基14-26存在明确的密度;S蛋白的氨基酸残基833和853之间形成折叠环(folded loop)。这个环是在S蛋白胞外结构域的封闭构象结构中折叠形成的,并可能在内体(endosome)的低pH条件下折叠。这些作者仅在氨基酸残基14-26观察到较弱的密度,但是他们没有观察到833-853区域形成折叠结构。这些作者进行过成像的SARS-CoV-2毒株含有广泛传播的D614G替换突变,这种突变破坏了这个氨基酸残基与K854之间形成的盐桥(图3d),并可能减少833-854折叠环的折叠。他们没有观察到对应于结合型脂质或其他结合型辅助因子的额外密度。S三聚体可能以罕见的构象存在着,但这不是它们在原位时的一般特征。
总的来说,这些作者确定的结构非常类似于通过双脯氨酸突变进行稳定化的可溶性三聚体胞外结构域在封闭融合前形式下的结构。这对正在使用的重组纯化S三聚体用于研究、诊断和疫苗接种提供了重要的验证,毕竟它们确实代表了S三聚体的原位结构。通过展示S三聚体在病毒表面上在3.4埃分辨率下的结构(图3),这些数据让这些作者乐观地认为,cryo-EM可以用于研究抗体结合病毒颗粒表面上的S三聚体。这样的研究可能提供中和抗体如何阻断病毒感染的新见解,特别是靶向S蛋白的膜近端区域的抗体,从而可以为用于疫苗接种的免疫原设计提供信息。(生物谷 Bioon.com)
参考资料:
Zunlong Ke et al. Structures and distributions of SARS-CoV-2 spike proteins on intact virions. Nature, 2020, doi:10.1038/s41586-020-2665-2.
在感染过程中,冠状病毒广泛地重塑细胞的内部膜结构,产生病毒复制细胞器以便在其中进行病毒复制。S蛋白,连同蛋白M和E,被插入到内质网(ER)的膜中,并被运送到内质网-高尔基体中间区室(ER Golgi intermediate compartment, ERGIC)。封装的基因组出芽到ERGIC中以形成病毒颗粒,随后将病毒颗粒运送到质膜并释放出去。S蛋白是通过先在S1/S2位点随后在S2'位点进行蛋白酶切割,从而为膜融合做好准备。
包括SARS-CoV-2在内的冠状病毒的S蛋白融合前结构已通过可溶性的分泌形式的S蛋白异位表达,随后进行纯化和cryo-EM成像,得到了广泛研究。在S蛋白融合前结构中,受体结合结构域(RBD)位于融合核心(fusion core)上方的一个较宽的S三聚体刺突结构的顶部。在含有三个RBD的S三聚体中,每个RBD被一个显示出一定流动性的N端结构域(NTD)包围着。在封闭的融合前结构中,所有三个RBD平铺在刺突结构表面上,在很大程度上封闭了受体结合位点,而在开放的融合前结构中,一个或多个RBD向上抬起,从而暴露受体结合位点。S三聚体的表面发生广泛的糖基化,每个S蛋白单体有22个潜在的N-糖基化位点。在结合受体ACE2后,从融合前到融合后的结构转变让S蛋白的融合肽和跨膜结构域聚集在一个以三螺旋束为中心的长针状结构的一端。五个N连接的聚糖沿融合后的S三聚体刺突结构的长度间隔分布。
充分理解S蛋白如何发挥作用,以及它们如何与免疫系统相互作用,需要了解病毒颗粒内S三聚体的结构、构象和分布。在一项新的研究中,来自英国医学研究理事会分子生物学实验室和德国海德堡大学的研究人员利用cryo-EM方法研究了S三聚体在病毒颗粒表面上的结构、构象和分布。相关研究结果于2020年8月17日在线发表在Nature期刊上,论文标题为“Structures and distributions of SARS-CoV-2 spike proteins on intact virions”。

图1.SARS-CoV-2病毒产生特征和图片,图片来自Nature, 2020, doi:10.1038/s41586-020-2665-2。
为了避免与病毒浓缩或纯化相关的伪影(artefacts),这些作者想要在不浓缩或纯化病毒的情形下对来自感染细胞的上清液的SARS-CoV-2病毒进行成像。利用SARS-CoV-2(病毒分离株Germany/BavPat1/2020)感染VeroE6细胞。在感染48小时后,上清液经澄清后用甲醛固定灭活,并在-80℃下储存。蛋白印迹法(Western blot)显示,病毒颗粒上大约45%的S蛋白单体在多精氨酸切割位点上切割成S1和S2(图1a)。固定的上清液通过骤冻玻璃化,并通过cryo-EM成像。固定可能有助于通过交联让一些蛋白构象稳定化,但预计不会产生任何新的构象。正如预期的那样,考虑到细胞上清液中病毒的浓度(约107个噬菌斑形成单位/ml, PFU/ml),他们发现少量的病毒颗粒分散在网格周围---这些病毒颗粒通过低温电子断层扫描(cryo-electron tomography, cryo-ET)成像(图1b)。
SARS-CoV-2病毒颗粒是近似球形的,到脂质双层外边缘的直径为91±11纳米(n = 179)。它们含有与N蛋白相对应的颗粒状密度,并缀有S三聚体(图1b,c)。这些特征与利用cryo-EM成像的其他冠状病毒的特征基本一致。从这种病毒表面上突出的S三聚体有两种形态--少数是延长的薄结构,这让人联想到融合后的构象,而大多数是更宽的结构,这让人联想到融合前的构象。这一观察结果与近期在预印本服务器上发表的一份论文(bioRxiv, 2020, doi:10.1101/2020.03.02.972927)---该论文显示了用核酸修饰剂β-丙内酯灭活的纯化SARS-CoV-2病毒的cryo-EM图像,在该图像中仅在病毒表面上观察到薄薄的突起---形成了鲜明的对比,但与原位观察到的病毒组装相一致。
这些作者还收集了SARS-CoV-2感染CALU-3细胞后产生的病毒颗粒的断层扫描图,其中Calu-3细胞是一种人肺癌细胞系,在病毒感染上产生的病毒滴度与VeroE6细胞相当。CALU-3细胞产生的这些病毒颗粒的形态和S三聚体在病毒颗粒表面上的外观与从VeroE6细胞产生的病毒颗粒所观察到的相一致。蛋白印迹分析表明,约73%的S蛋白为裂解形式。
SARS-CoV-2病毒颗粒含有24±9个S三聚体。这个值低于之前假设S蛋白等距离分布的估计值,这是因为S蛋白在病毒表面分布不均匀。一小群病毒颗粒仅含有很少的S三聚体,而较大的病毒颗粒则含有更多的S三聚体。这些作者从179个病毒颗粒中鉴定出4104个宽的S三聚体和116个薄的S三聚体,并对它们进行子断层扫描图平均化(subtomogram averaging)。平均化的结构,在7.7和22埃的分辨率下,分别非常好地对应于之前公布的纯化S三聚体在融合前和融合后形式下的结构(图2a)。总体而言,约97%的S三聚体是融合前形式,3%是融合后形式。融合前和融合后的S三聚体形式似乎是均匀地分布在病毒颗粒中。

图2.针对完整病毒颗粒上的SARS-CoV-2 S三聚体的结构分析,图片来自Nature, 2020, doi:10.1038/s41586-020-2665-2。
病毒表面上的融合前S三聚体可能主要处于封闭构象,它的开放构象可通过ACE2结合诱导或稳定化,或者它在融合前也可能存在开放构象。当用作免疫原时,开放或封闭的构象可诱导不同范围的抗体,目前人们正在努力产生稳定在其中一种构象的S蛋白构造体。
为了评估S三聚体是否存在于开放和/或封闭的构象,这些作者对S三聚体中的S蛋白单体的RBD区域进行分类。他们发现三种类型:RBD处于封闭位置的S蛋白;RBD处于开放位置的S蛋白;RBD以封闭位置为主但密度有所减弱的S蛋白,这表明存在更多的可移动构象。
考虑到每个S蛋白单体被分配到的类型,这些作者推导出完全封闭的S三聚体结构,以及其中一个RBD是开放的S三聚体结构,这两者分别代表了3854个融合前S三聚体中的约31%和约55%(图2b)。他们还发现了少量S三聚体(3854个融合前S三聚体中的约14%)的两个RBD处于开放构象(图2b)。这些观察结果证实在重组S三聚体中观察到的RBD的开放也发生在病毒表面上,并且稳定在封闭和开放构象中的人工S蛋白构造体都代表了原位存在的结构。因此,这种受体结合位点在原位随机暴露,并可与ACE2以及与抗体相互作用。
这些S三聚体并不都是直接从病毒表面突出来的。它们可以向膜倾斜90°,尽管倾斜超过50°就不那么有利。这些作者根据S三聚体相对于膜的方向对它们进行分组,并且分别对每组进行平均化。这些平均化的结构表明膜近端茎区域作为一个铰链有足够的灵活性,允许向各个方向倾斜(图2c)。
这些作者构建出SARS-CoV-2病毒颗粒的模型,在该模型中,S三聚体的位置、方向和构象是通过子断层扫描图平均化确定的(图2d)。S三聚体似乎是随机分布在病毒表面上,它们的位置、方向和构象之间没有明显的聚类或关系。在SARS-CoV-2中,每1000 平方纳米膜表面大约有一个S三聚体,相比之下,在甲型流感病毒中,每100平方纳米膜表面大约有一个S三聚体。在SARS-CoV-2中,S蛋白的稀疏分布以及它们主要处于封闭状态意味着与大流行性流感病毒相比,受体结合可能较少依赖于亲和效应。这与S蛋白和ACE2之间的亲和力(在nM范围内)比血凝素和唾液酸之间的亲和力(mM范围)高相一致。
上清液中低浓度的病毒颗粒使得解析出高分辨率的结构变得困难。因此,这些作者通过蔗糖垫层离心沉淀法对这些病毒颗粒进行浓缩。浓缩的病毒颗粒偏离球形形态,但是它们的整体特征仍保留下来。他们对这些病毒颗粒进行了cryo-ET成像和子断层扫描图平均化,观察到的主要是融合前S三聚体,偶尔有融合后S三聚体。在对融合前S蛋白进行分类后,他们只能识别出处于封闭位置的RBD,以及观察到RBD密度较弱的S蛋白单体。
从感染细胞的上清液中的病毒颗粒主要显示融合前S三聚体,这些S三聚体处于封闭或开放的融合前构象。通过蔗糖垫层离心法浓缩的病毒颗粒继续呈现融合前构象,但不再观察到开放构象。其他研究已表明,用β-丙内酯,而不是甲醛灭活的病毒颗粒主要处于融合后状态。从膜中纯化的S三聚体仅处于封闭的融合前构象和融合后构象,而其他研究已提示着可溶性S三聚体中的开放RBD是在一系列连续不同的位置中发现的。这些观察表明这些作者在浓缩之前而不是浓缩之后观察到的S蛋白的开放融合前构象是脆弱的(尽管文中进行了固定),并可能受到纯化过程的影响。
这些作者的数据提示着灭活和纯化方法可以改变融合前和融合后形式的比例,以及开放和封闭形式的比例。据推测,病毒表面上大量的融合后S蛋白可能通过屏蔽融合前形式保护这种病毒,或者可能将宿主反应转向非中和抗体。鉴于在完整的病毒颗粒上观察到小一部分融合后S三聚体刺突结构,这些作者认为这不太可能是病毒在感染过程中的重要防御机制,但它可能是疫苗接种的一个重要考虑因素。基于灭活病毒颗粒的候选疫苗正在开发中。根据不同的制备方式,这些疫苗可能会向免疫系统呈现不同的S蛋白表位,因此它们诱导中和反应的能力也不同。比如,β-丙内酯经常用于疫苗生产(如用于流感病毒亚单位疫苗),但如果融合后S三聚体诱导非中和反应,那么β-丙内酯可能不是SARS-CoV-2病毒S蛋白疫苗配方制备期间用于病毒灭活的最佳选择。
接下来,这些作者利用cryo-EM对浓缩的SARS-CoV-2病毒进行二维成像,并对那些从病毒颗粒侧面突出的融合前S三聚体进行单颗粒分析,从而产生3.4埃分辨率的融合前S三聚体共识结构。对RBD单体进行集中分类和部分信号减法,可将它们分为两类。与通过cryo-ET发现样品中不存在开放构象相一致的是,这些作者观察到81%的S蛋白单体中RBD处于封闭构象,19%的S蛋白单体中RBD的密度较弱,但主要处于封闭位置。他们将所有三个RBD都处于封闭构象的S三聚体(53%的数据)以及至少一个RBD的密度减弱的S三聚体(47%的数据)的结构分别优化到3.5埃和4.1埃的分辨率(图3a)。这两种结构高度相似,仅在一个RBD的密度水平上有所不同。他们利用这种具有三个封闭RBD的结构,建立并完善了S三聚体在病毒表面原位的原子模型。

图3.利用单颗粒重建方法确定SARS-CoV-2 S三聚体在完整病毒颗粒上的结构,图片来自Nature, 2020, doi:10.1038/s41586-020-2665-2。
在这些作者建立的结构中,S蛋白表面上的聚糖位置得到了很好的解决:在22个预测的N-糖基化位点中,有17个存在密度(图3b)。其他5个糖基化位点位于无序的NTD环或茎区域,并没有在高分辨率下解决。在S三聚体的底部,一个清晰的聚糖环在茎区域上形成一个项圈。相比于已公布的可溶性胞外结构域结构,茎区域的密度延伸了2个螺旋转弯(helical turn)并在更低的分辨率下进一步延长,直到由于茎区域的灵活性而逐渐消失(图3c)。SARS-CoV-2的S三聚体分布稀疏,可以高度向膜倾斜。这意味着,在头部区域基部和茎区域的抗原表位将被抗体接触到,在那里它们得不到聚糖壳的广泛保护。
这些作者比较了S三聚体的原位结构和以前使用外源表达的纯化蛋白获得的结构。最近的一项针对溶于去污剂胶团的全长S三聚体的研究确定了在可溶性S蛋白胞外结构域三聚体的大多数结构中没有观察到的两个特征:S蛋白的氨基酸残基14-26存在明确的密度;S蛋白的氨基酸残基833和853之间形成折叠环(folded loop)。这个环是在S蛋白胞外结构域的封闭构象结构中折叠形成的,并可能在内体(endosome)的低pH条件下折叠。这些作者仅在氨基酸残基14-26观察到较弱的密度,但是他们没有观察到833-853区域形成折叠结构。这些作者进行过成像的SARS-CoV-2毒株含有广泛传播的D614G替换突变,这种突变破坏了这个氨基酸残基与K854之间形成的盐桥(图3d),并可能减少833-854折叠环的折叠。他们没有观察到对应于结合型脂质或其他结合型辅助因子的额外密度。S三聚体可能以罕见的构象存在着,但这不是它们在原位时的一般特征。
总的来说,这些作者确定的结构非常类似于通过双脯氨酸突变进行稳定化的可溶性三聚体胞外结构域在封闭融合前形式下的结构。这对正在使用的重组纯化S三聚体用于研究、诊断和疫苗接种提供了重要的验证,毕竟它们确实代表了S三聚体的原位结构。通过展示S三聚体在病毒表面上在3.4埃分辨率下的结构(图3),这些数据让这些作者乐观地认为,cryo-EM可以用于研究抗体结合病毒颗粒表面上的S三聚体。这样的研究可能提供中和抗体如何阻断病毒感染的新见解,特别是靶向S蛋白的膜近端区域的抗体,从而可以为用于疫苗接种的免疫原设计提供信息。(生物谷 Bioon.com)
参考资料:
Zunlong Ke et al. Structures and distributions of SARS-CoV-2 spike proteins on intact virions. Nature, 2020, doi:10.1038/s41586-020-2665-2.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


