Cell:新研究成功构建出模拟 tau 蛋白聚集物扩散的人类神经元模型
来源:生物谷原创 2024-04-24 12:11
为了阻止tau传播,Gan团队采用CRISPRi筛选技术让一千个基因失活,以确定它们在tau传播中的作用。他们发现了500个对tau丰度有重大影响的基因。
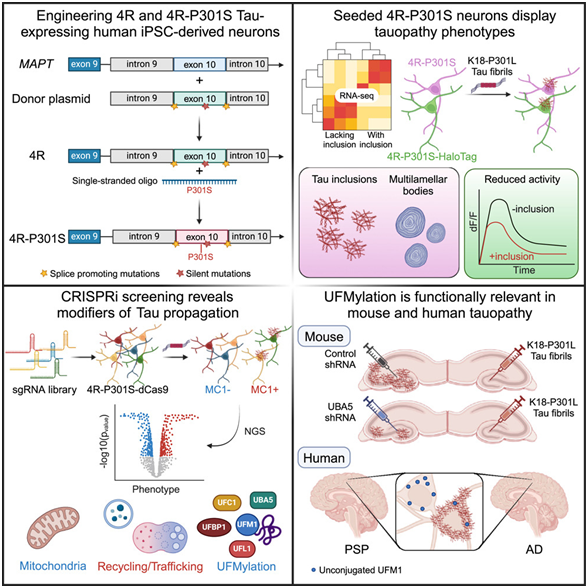
在一项新的研究中,来自美国威尔康奈尔医学院的研究人员开发出一种创新的人类神经元模型,该模型能有力地模拟 tau 蛋白聚集物在大脑中的扩散---这一过程是阿尔茨海默病和额颞叶痴呆症认知能力下降的原因。通过这种新模型,他们发现了有可能阻止 tau 扩散的新型治疗靶点。这项临床前研究是阿尔茨海默病研究的重大进展。相关研究结果于2024年4月5日在线发表在Cell期刊上,论文标题为“Human iPSC 4R tauopathy model uncovers modifiers of tau propagation”。

论文共同通讯作者Li Gan博士说,“目前没有任何疗法能够阻止阿尔茨海默病患者大脑中tau聚集物的扩散。我们的tau扩散人类神经元模型克服了以往模型的局限性,并揭示了以前未知的潜在靶点用于药物开发。”
人类诱导性多能干细胞(iPSC)可发育成人体的任何细胞,并可在实验室培养皿中诱导成为神经元,从而建立大脑疾病模型。然而,在这些所形成的神经元中建立tau传播模型几乎是不可能的,因为tau传播需要在衰老的大脑中进行数十年。
Gan博士及其团队利用CRISPR技术修改了人类iPSC的基因组,促使它们表达与患病的衰老大脑相关的tau形式。Gan博士说,“这种模型改变了游戏规则,它能在数周内模拟tau在神经元中的扩散,而这个过程在人脑中通常需要数十年。”
为了阻止tau传播,Gan团队采用CRISPRi筛选技术让一千个基因失活,以确定它们在tau传播中的作用。他们发现了500个对tau丰度有重大影响的基因。
论文共同第一作者、在Gan实验室开研究工作的威尔康奈尔医学院医学科学研究生院神经科学博士生Celeste Parra Bravo说,“CRISPRi技术让我们能够使用无偏见的方法来寻找药物靶点,而不局限于其他科学家之前报道的内容。”
图片来自Cell, 2024, doi:10.1016/j.cell.2024.03.015
其中的一个发现包括 UFMylation 级联,这是一个细胞过程,涉及一种名为 UFM1 的小蛋白与其他蛋白的连接。这一过程与 tau 扩散之间的联系以前并不为人所知。对阿尔茨海默病患者大脑的死后研究发现,UFMylation 发生了改变,而且这些作者还在临床前模型中发现,抑制 UFMylation 所需的酶可以阻止 tau 在神经元中的传播。
论文共同作者、威尔康奈尔医学院阿佩尔研究所神经科学研究副教授 Shiaoching Gong 博士说,“抑制 UFMylation 可以阻止 tau 在人类神经元和小鼠模型中的传播,这一结果尤其令我们感到鼓舞。”
Gan博士说,许多阿尔茨海默病治疗方法最初在小鼠模型中显示出前景,但在临床试验中并不成功。有了这种新的人类细胞模型,她对未来的道路感到乐观。“我们在人类神经元中的发现为开发可能真正改变这种毁灭性疾病患者的命运的新疗法打开了一扇大门。”(生物谷 Bioon.com)
参考资料:
Celeste Parra Bravo et al. Human iPSC 4R tauopathy model uncovers modifiers of tau propagation. Cell, 2024, doi:10.1016/j.cell.2024.03.015.
Human Neuron Model Paves the Way for New Alzheimer’s Therapies
https://news.weill.cornell.edu/news/2024/04/human-neuron-model-paves-the-way-for-new-alzheimer%E2%80%99s-therapies
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


