同济大学刘琦团队开发新型AI模型,用于CRISPR靶向预测和优化
来源:生物世界 2023-12-04 09:34
该研究将关键互作特征用于开发一个全新的、高效的脱靶效应打分方法,即CRISOT-Score(图1d),用于计算给定脱靶序列的脱靶打分。
近日,同济大学生命科学与技术学院生物信息学系、同济大学-上海自主智能无人系统科学中心刘琦教授课题组,联合之江实验室、罗氏上海创新中心和中国农业科学院等团队,在 Nature Communications 期刊发表了题为:Genome-wide CRISPR off-target prediction and optimization using RNA-DNA interaction fingerprints 的研究论文。
该研究发布了领域内首个基于分子互作指纹的CRISPR靶向效应预测和sgRNA优化模型——CRISOT(CRISPR Off-Target)。
针对CRISPR脱靶预测中面临的瓶颈,融合分子动力学(molecular dynamics,MD)模拟和人工智能(artificial intelligence,AI)技术,利用MD模拟分析和构建CRISPR的RNA-DNA分子互作指纹,结合AI算法开发CRISPR脱靶预测模型,并提出有效的向导RNA(sgRNA)优化方法。GUIDE-seq和WGS实验均证明,CRISOT在全基因组脱靶效应预测和sgRNA优化上的高准确率和泛化性能。

该研究开发的CRISOT工具包包含四个模块(图1),即CRISOT-FP、CRISOT-Score、CRISOT-Spec和CRISORT-Opti,分别用于分子互作指纹生成、全基因组CRISPR脱靶预测、sgRNA靶向特异性评估和Cas9系统的sgRNA优化。依托之江智能计算基因平台,CRISOT网站目前已发布于https://crisot.aigene.org.cn/,方便研究人员使用。
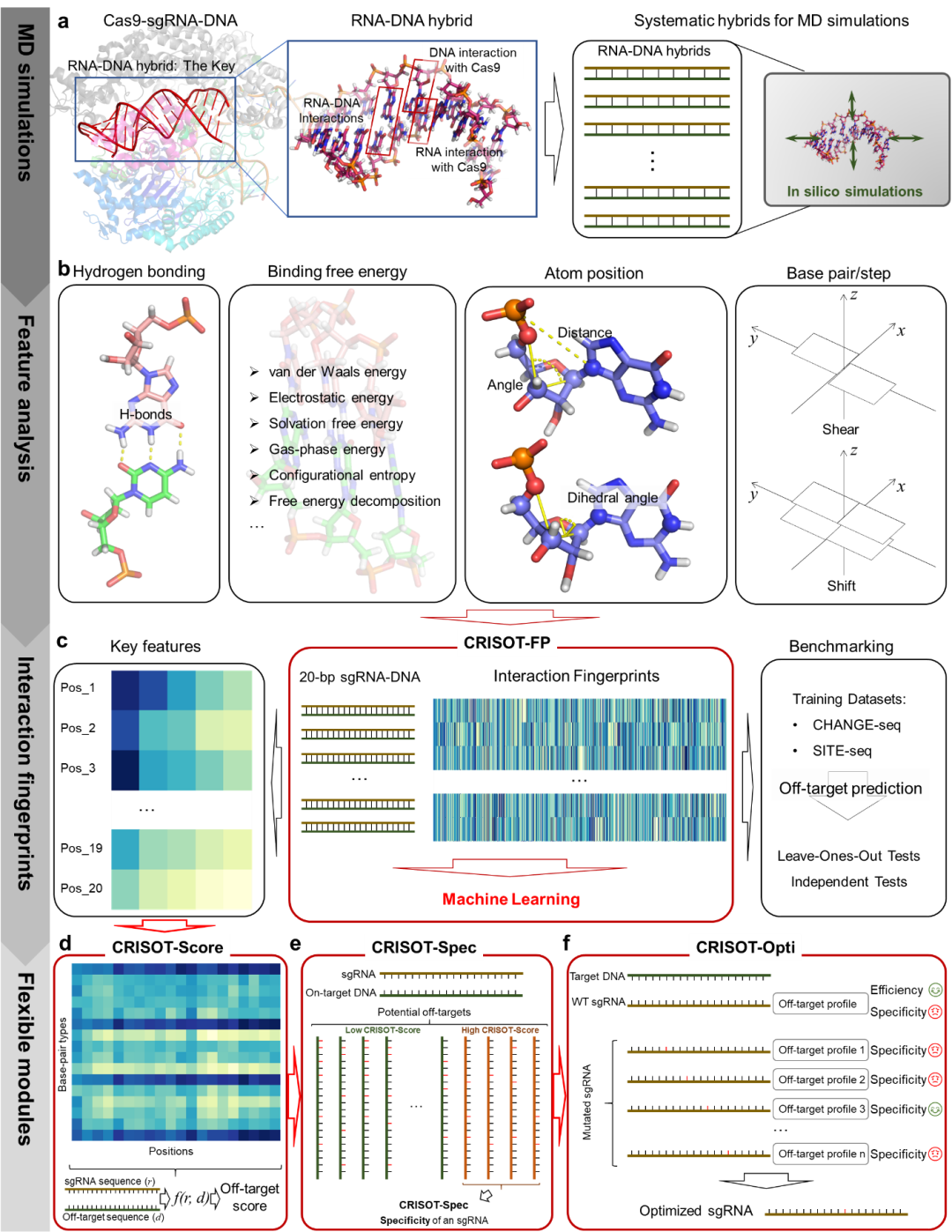
图1. 结合分子机制的Cas9靶向效应预测的计算框架
CRISPR-Cas9介导的DNA剪切的分子机制,是由Cas9-sgRNA-DNA复合体内部的一系列互作驱动的,这些分子互作也决定了其脱靶效应的产生。本研究以Cas9-sgRNA-DNA复合体的核心——sgRNA-DNA为基础(图1a),设计并开展MD模拟表征CRISPR系统的RNA-DNA分子互作特征,包括氢键、结合自由能、原子位置和碱基对的几何特征等(图1b),这些特征构成了sgRNA-DNA的分子互作指纹,即CRISOT的第一个也是首要的模块——CRISOT-FP(图1c)。CRISOT-FP可以作为一种分子指纹(表征),以一种灵活的方式与不同的AI模型结合,用于预测CRISPR脱靶效应,本研究开发的模型表现出优秀的脱靶效应预测能力。
在此基础上,该研究将关键互作特征用于开发一个全新的、高效的脱靶效应打分方法,即CRISOT-Score(图1d),用于计算给定脱靶序列的脱靶打分。基于CRISOT-Score,通过叠加sgRNA在全基因组范围内所有CRISOT-Score打分高的脱靶位点,得到衡量该sgRNA靶向特异性的打分,即CRISOT-Spec(图1e)。
最后,该研究基于CRISOT-Score和CRISOT-Spec,开发了一种创新性的优化sgRNA的方法,即CRISOT-Opti(图1f)。面向靶向特异性不尽如人意的sgRNA,CRISOT-Opti通过引入单碱基突变获得突变体sgRNA并从中识别能维持一定打靶活性同时靶向特异性大大提升的突变体sgRNA。
该研究通过全面的计算和实验测试表明,CRISOT相较于现有工具的脱靶预测性能获得了很大的提升,且在准确预测BE(base editor)和PE(prime editor)的脱靶效应方面显示出潜力,表明RNA-DNA分子互作指纹捕获了不同CRISPR系统之间RNA-DNA相互作用的潜在机制。该研究所采用的引入分子动力学(MD)的方法,本质上是一种结合物理先验的AI方法,可以克服全基因组范围内脱靶预测模型对于大量训练样本的依赖,体现出一种考虑物理先验的小样本和可解释性的AI思想。
基因编辑作为一种疾病干预手段,已逐渐进入临床阶段,2023年11月16日,全球首个基于CRISPR-Cas9的基因编辑疗法CasgevyTM在英国获得有条件的上市许可,用于治疗镰刀状细胞贫血病(SCD)和输血依赖β-地中海贫血(TDT),然而,其潜在脱靶问题及由此带来的健康风险仍将持续受到关注。该研究通过全基因组测序实验表明,CRISOT成功优化了靶向原发性高胆固醇血症关键基因PCSK9和镰刀状细胞贫血病关键基因BCL11A的sgRNA,提高了其靶向特异性,表明了CRISOT是全基因组CRISPR脱靶预测、评估和sgRNA优化的一个有效和可推广的系统,可降低CRISPR基因组编辑中的脱靶风险。
可以预见,CRISOT将有助于sgRNA设计和优化,推动基因编辑进入临床级别的应用。
该论文通讯作者是同济大学刘琦教授、原罗氏上海创新中心张清博士和中国农业科学院左二伟研究员,共同第一作者为之江实验室陈钦畅、同济大学啜国晖和中国农业科学院张海航。该工作目前依托罗氏和同济大学,已申请国际PCT专利一项,后续正在开展进一步的临床转化研究。
刘琦教授课题组(https://bm2.tongji.edu.cn)致力于组学人工智能赋能的精准医学研究,在基因编辑系统的AI优化设计和新型基因编辑系统识别领域开发了一系列AI计算平台。于2018年发布了领域内首个基于预训练大模型的基因编辑优化设计平台DeepCRISPR(Genome Biology 2018);于2020年发布了领域内首个脱靶预测基准评估的计算平台iGWOS(Nucleic Acids Research 2020); 于2022年提出了结合MD和AI进行基因编辑系统优化和识别的观点论文(Science Bulletins 2022)。本次工作是在上述研究基础上的进一步突破。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


