李华兵/伊成器/吴玉章合作揭示tRNA-m1A修饰调控CD4+T细胞功能的新机制
来源:生物世界 2022-09-26 16:02
该研究首次详细地阐明了 CD4+T 细胞功能改变过程中 tRNA 化学修饰控制细胞内翻译的分子机制。
近日,上海交通大学医学院李华兵研究员、北京大学生命科学学院伊成器教授、陆军军医大学吴玉章和耶鲁大学医学院 Richard Flavell 团队合作,在 Nature Immunology 期刊上发表了题为:tRNA-m1A modification promotes T cell expansion via efficient MYC protein synthesis 的研究论文。
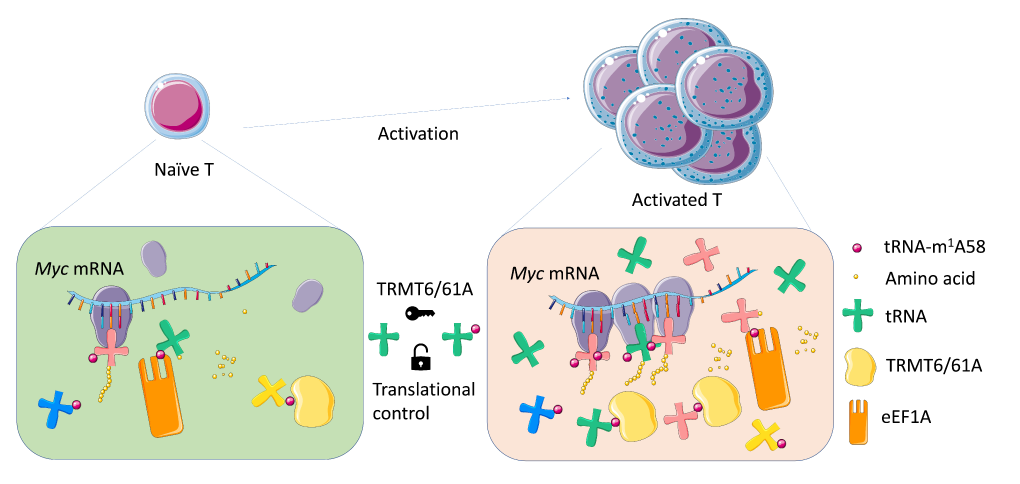
该研究揭示了 m1A 修饰催化酶 TRMT61A 通过催化新合成 tRNA 第58位腺嘌呤的1-甲基腺嘌呤(m1A)修饰,加速 CD4+T 细胞激活后多种关键蛋白的翻译,保证 CD4+T 细胞的迅速免疫应答。
该研究首次详细地阐明了 CD4+T 细胞功能改变过程中 tRNA 化学修饰控制细胞内翻译的分子机制。

T 细胞在免疫反应中发挥核心作用。当受抗原刺激时,处于静息状态的T细胞快速激活,大量增殖分化。免疫激活是免疫反应中非常重要的一步,之前的研究集中于探究转录调控在T细胞激活过程中的作用。鉴于 T 细胞激活在短时间内快速发生,转录调控不能及时满足T细胞大量合成蛋白的需求,因此翻译效率的调控可能也发挥重要作用。
tRNA 在翻译过程中发挥着重要作用。除了 tRNA 丰度之外,tRNA 上的化学修饰可以通过稳定 tRNA 结构,帮助 tRNA 进行 codon 识别等途径影响翻译过程。其中,m1A 是 tRNA 上丰度最高最保守的一种修饰,由TRMT6/TRMT61A 复合物进行修饰,tRNA-m1A 修饰可以增强翻译起始和延伸。伊成器课题组在2017年建立了 m1A 修饰位点的单碱基分辨率鉴定技术。
该研究首先观察到 T 细胞激活过程中蛋白质翻译相关通路上调,不同的 tRNA 也表现出不同时间点上调的动态表达模式,tRNA-m1A58 修饰酶 TRMT6/TRMT61A 在激活过程中也上调。作者利用 Trmt61a 条件性敲除小鼠,证明在体内、体外条件下,Trmt61a 缺失时 T 细胞激活免疫功能受损,T 细胞增殖能力显著降低。同时,发现 rmt61a 缺失导致T细胞中大部分 tRNA 的 m1A58 修饰显著减少,导致 T细胞激活后多种关键蛋白的翻译受阻,特别是转录因子 MYC。MYC 蛋白翻译效率的降低使 T 细胞激活后的快速克隆扩增受阻。
作者随后探究了 Trmt61a 调控翻译的特异性。通过对 RiboTag-seq、tRNA-seq、tRNA-m1A-seq 的多组学联合分析,研究人员发现翻译效率下调的基因(如Myc)有 tRNA codon 使用偏好性,更偏好使用在激活早期高表达的 tRNA,而这部分 tRNA 又是 Trmt61a 缺失高度敏感的 tRNA。
该研究第一次将 tRNA 修饰与 T 细胞的功能变化连接起来,并系统性地探究了原代 T 细胞扩增过程中控制翻译的具体机制,表明 tRNA 的使用及其修饰可以对蛋白表达和细胞功能带来显著改变。这项研究表明 TRMT61A 介导的 tRNA-m1A58 修饰作为 CD4+T 细胞增殖调控的新型“翻译检查点”,将为改善 CD4+T 细胞介导的炎症应答及增强肿瘤免疫治疗效果提供新的 RNA 表观遗传策略。
上海交通大学医学院刘永波博士、周静副研究员和硕士研究生施金彤,北京大学生命科学学院已出站博士后李笑雨(现浙江大学医学院研究员),博士研究生张晓婷为论文的共同第一作者,上海交通大学医学院李华兵研究员、北京大学生命科学学院伊成器教授、陆军军医大学吴玉章教授及耶鲁大学医学院 Richard A.Flavell 教授为该文的共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


