Science子刊:免疫-纳米颗粒+衰老诱导剂,双管齐下治疗胰腺癌
来源:生物世界 2024-09-03 15:47
该研究开发了一种免疫疗法方法,通过脂质纳米颗粒共封装的STING和TLR4先天性免疫激动剂与衰老诱导RAS靶向疗法结合,可以通过衰老相关分泌表型(SASP)重塑PDAC的免疫抑制性肿瘤微环境。
马萨诸塞大学的研究人员在 Science 子刊 Science Translational Medicine 上发表了题为:Nanoparticle delivery of innate immune agonists combined with senescence-inducing agents promotes T cell control of pancreatic cancer 的研究论文。
该研究表明,使用纳米颗粒递送先天性免疫激动剂(STING激动剂、TLR4激动剂)联合衰老诱导剂(MEK抑制剂、CDK4/6抑制剂),能够促进T细胞控制胰腺癌,产生了强大的T细胞驱动和I型干扰素介导的肿瘤消退和长期生存。

此前的研究表明,RAS靶向疗法不仅可以通过上调肿瘤细胞的MHC-I分子来增加抗原呈递,还可以诱导细胞衰老和随后的衰老相关分泌表型(SASP),包括能够以动态方式重塑免疫抑制性TME的血管生成和炎症因子。
在KRAS突变的肺腺癌模型中,靶向下游KRAS信号通路的丝裂原活化蛋白激酶激酶(MEK)抑制剂曲美替尼(Trametinib,简称T)和细胞周期素依赖性激酶4/(CDK4/6)抑制剂帕柏西利(Palbociclib,简称P)的联合治疗可诱导促炎性的衰老相关分泌表型(SASP),导致NK细胞介导的肺肿瘤消退。相比之下,在KRAS突变的胰腺导管腺癌(PDAC)模型中,使用相同的T/P治疗方案治疗可诱导促血管生成的SASP,促进血管重塑和内皮细胞激活,从而增加化疗药物的递送、细胞毒性T淋巴细胞转运和抗PD-1免疫检查点疗法的疗效。
这些针对特定器官的免疫反应的差异似乎是由宿主微环境决定的。特别是最近发现,在PDAC的肿瘤微环境中普遍存在的成纤维细胞有助于抑制T/P治疗后的促炎性SASP因子,并增强NK细胞和CD8+T细胞的免疫反应。
针对PDAC的肿瘤微环境驱动的免疫抑制机制导致激活了干扰素调节因子(IRF)的表达和下游干扰素信号通路,这表明激活干扰素信号通路可能是激活PDAC中细胞毒T淋巴细胞活性的一种方法。
STING(干扰素基因刺激因子)通路是I型干扰素产生的主要调节因子,现已成为一种重要的先天免疫通路,可增强抗肿瘤NK细胞和T细胞免疫。在体外和小鼠体内的临床前研究中,给予cGAMP和其他合成的STING激动剂已被证明可以刺激抗原呈递的树突状细胞,重编程免疫抑制性巨噬细胞,减少抑制性的调节性T细胞(Treg)的数量,并增加CD8+T细胞的激活,从而产生抗肿瘤效果。
虽然STING激动剂作为潜在的免疫疗法具有很大的潜力,但由于以下原因,其临床开发受到了限制:
1、由于细胞摄取量有限和血浆半衰期较短,STING激动剂的药代动力学特性和生物利用度不佳;
2、系统性给药时可能出现的不良毒性和免疫抑制效应;
3、包括胰腺在内的一些肿瘤部位难以进行肿瘤内注射。
为了克服这些局限性,研究团队设计了基于脂质的纳米颗粒,使STING激动剂能够在全身范围内被递送,并由于其较小的尺寸和“隐形”表面涂层而优先沉积和被肿瘤周围的“渗漏”区域内的抗原呈递细胞摄取,从而延长了循环时间。利用纳米颗粒可以作为多种免疫刺激剂载体的事实,研究团队不仅将STING激动剂环二鸟苷单磷酸(cdGMP)装载到纳米颗粒中,还将Toll样受体4(TLR4)激动剂单磷酸脂质A(MPLA)装载到纳米颗粒中,以进一步刺激Ⅰ型干扰素(IFN)反应。
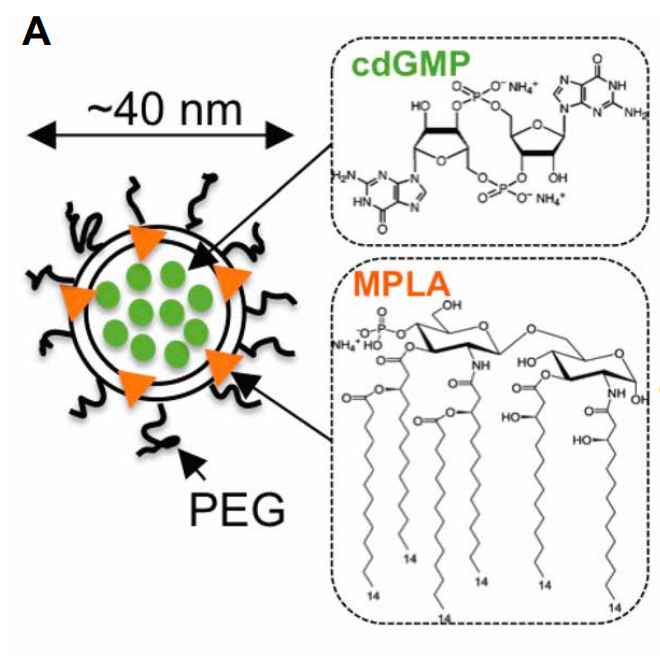
研究团队在黑色素瘤和三阴性乳腺癌模型中证明,在纳米颗粒中系统性共递送STING和TLR4激动剂,可使它们进入甚至血管化不良的肿瘤微环境(TME)中,并导致比仅携带单一激动剂的纳米颗粒更高的干扰素β(IFN-β)产生。在这些肿瘤模型中,免疫-纳米颗粒疗法导致了强大的先天性免疫反应(抗原呈递细胞和自然杀伤细胞)和适应性免疫反应(细胞毒性T淋巴细胞),抑制了肿瘤生长,延长了生存时间,这种治疗效果无法通过直接递送激动剂或抗PD-1单抗治疗实现。
研究团队推测,将T/P疗法与免疫-纳米颗粒疗法结合起来,可以协调免疫细胞、肿瘤细胞和肿瘤微环境中的血管之间的免疫抑制网络,从而产生持久的抗肿瘤T细胞反应。
在这项研究中,研究团队使用同基因移植和原发性PDAC小鼠模型,发现联合治疗导致肿瘤微环境中多种细胞类型对免疫-纳米颗粒的摄取增加,激活了I型干扰素和与SASP相关的细胞因子和趋化因子,并上调了肿瘤细胞和抗原呈递细胞上的抗原呈递,最终导致持续的IFN-α和IFN-β受体亚基1(IFNAR)依赖的、由CD8+T细胞介导的抗PDAC免疫反应。
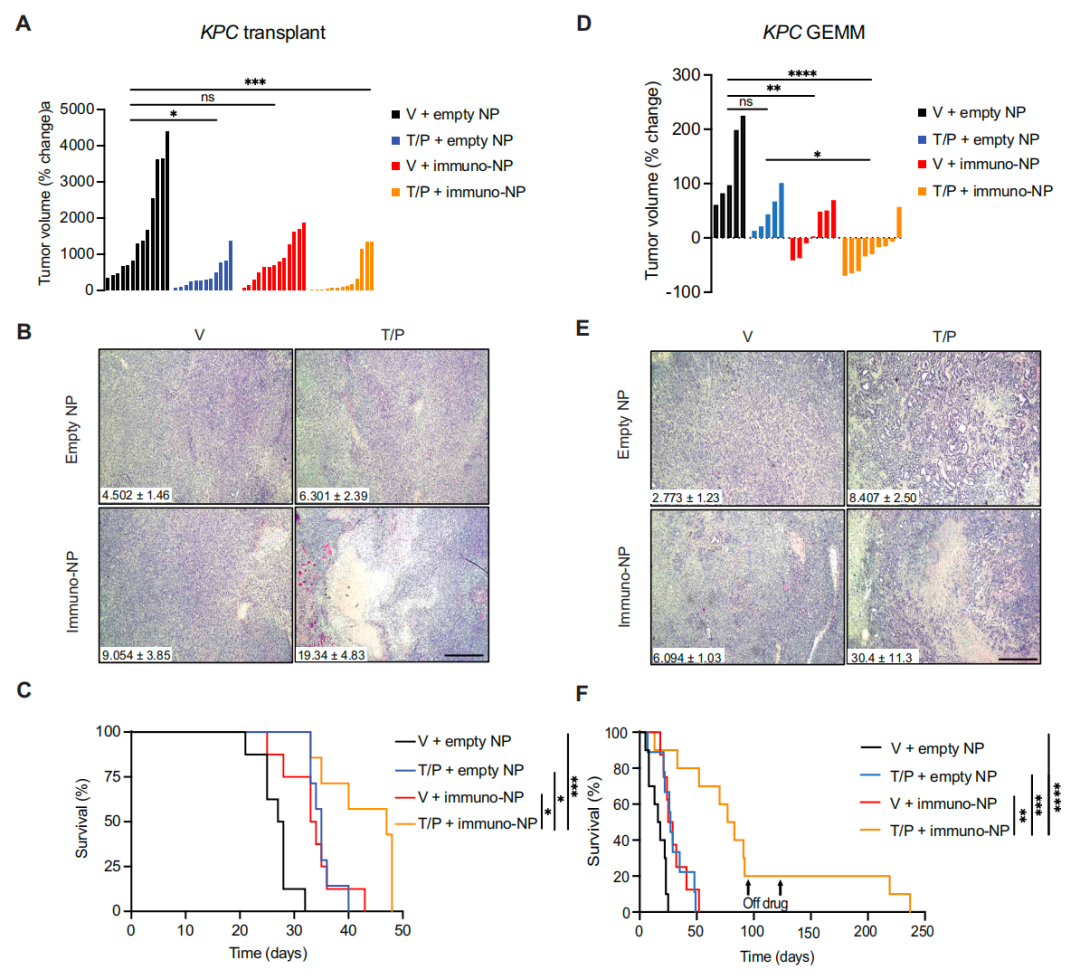
总的来说,该研究开发了一种免疫疗法方法,通过脂质纳米颗粒共封装的STING和TLR4先天性免疫激动剂与衰老诱导RAS靶向疗法结合,可以通过衰老相关分泌表型(SASP)重塑PDAC的免疫抑制性肿瘤微环境。将该联合疗法应用于PDAC小鼠模型,能够增强PDAC肿瘤微环境中多种细胞类型对纳米颗粒的摄取,诱导I型干扰素和其他促炎信号通路,增加肿瘤细胞和抗原呈递细胞的抗原呈递,并随后激活先天性免疫反应和适应性免疫反应。
这种双管齐下的治疗策略产生了强大的T细胞驱动和I型干扰素介导的肿瘤消退和长期生存。因此,将局部免疫激动剂递送与系统性肿瘤靶向治疗相结合,可以协调I型干扰素驱动的先天性免疫反应和适应性免疫反应,产生持久的抗肿瘤效果,以对抗胰腺导管腺癌(PDAC)。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


