Nat Immunol:揭示溶血磷脂酰丝氨酸抑制机体自然杀伤性细胞抗肿瘤活性背后的分子机制
来源:生物谷原创 2024-11-25 11:54
本文研究结果表明,操控1型先天性淋巴样细胞或能诱导强大的抗肿瘤免疫,而且GPR34或能作为一种新型的代谢免疫检查点,从而有望被靶向作用来开发基于1型先天性淋巴样细胞的新型免疫疗法。
1型先天性淋巴样细胞(ILC1s,Type 1 innate lymphoid cells)是一类具有抗肿瘤活性的组织驻留细胞,其或许在实体瘤免疫监视过程中发挥着重要作用,但目前研究人员并不清楚是否操控ILC1s就能诱导潜在的抗肿瘤免疫反应。近日,一篇发表在国际杂志Nature Immunology上题为“GPR34 is a metabolic immune checkpoint for ILC1-mediated antitumor immunity”的研究报告中,来自中国科学技术大学等机构的科学家们通过研究发现了溶血磷脂酰丝氨酸(LysoPS,lysophosphatidylserine)通过其受体抑制自然杀伤性细胞(NK细胞)抗肿瘤活性背后的分子机制,同时他们还提出了一种基于受体拮抗作用的新型免疫疗法策略。
尽管近年来免疫疗法已经改变了人类癌症的治疗模式,但其疗效仍然有限,患者的反应率低于30%,尤其是肝癌和结直肠癌,这或许就强调了开发新型免疫疗法并发现新型靶点的迫切需要;传统的自然杀伤性细胞(cNK细胞)在肿瘤免疫中发挥着至关重要的角色,但在穿透肿瘤组织并维持其在肿瘤微环境中的功能方面却面临着一定的障碍。
有意思的是,在肝脏和肠道组织中大量存在的1型先天性淋巴样细胞被发现能表现出促肿瘤和抗肿瘤的活性,然而,其与cNK细胞的表型相似性却阻碍了靶向性疗法的开发,从而让研究人员对其在肿瘤免疫中的精确功能并不是非常清楚。为了揭开这一奥秘,研究人员开发了tdTomato-GPR34受体小鼠,结果发现,GPR34会在1型先天性淋巴样细胞上大量表达,但在cNK细胞上并不表达,这就证明,GPR34或能充当区分1型先天性淋巴样细胞和cNK细胞的新型标志物。
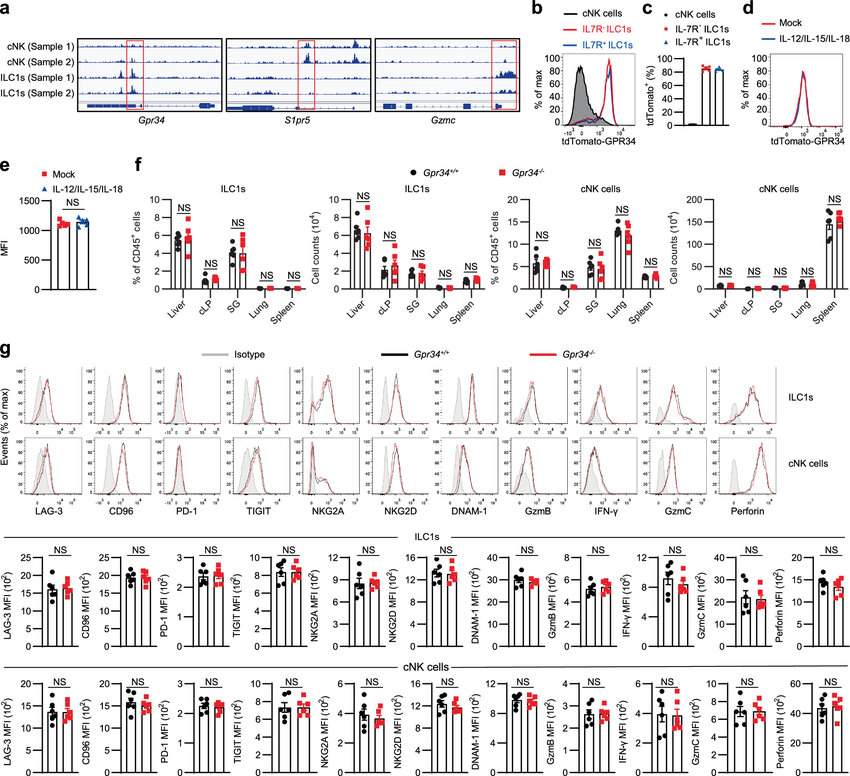
揭示GPR34在ILC1s和cNK细胞百分比或功能所扮演的关键角色
通过利用多种皮下肿瘤模型和结直肠癌肝脏转移模型,研究人员发现,全身性的GPR34基因缺陷和1型先天性淋巴样细胞特异性缺陷均可增加1型先天性淋巴样细胞在肿瘤中的比例、数量和抗肿瘤活性,从而就能抑制肿瘤生长,这也表明,GPR34能通过抑制1型先天性淋巴样细胞的抗肿瘤活性来促进肿瘤生长。接下来,研究人员探索了GPR34调节1型先天性淋巴样细胞介导的抗肿瘤免疫力背后的分子机制,质谱分析结果表明,GPR34的配体LysoPS能在肿瘤间隙液中积累,体外实验结果表明,LysoPS能通过cAMP-PKA-CREB通路以GPR34依赖性的方式来抑制1型先天性淋巴样细胞的活性。
对肿瘤细胞中LysoPS合成酶ABHD16A的表达敲除就能降低肿瘤间隙液中LysoPS的水平,并抑制肿瘤生长,此外,抑制LysoPS的产生还能增加肿瘤中1型先天性淋巴样细胞的数量、比例和抗肿瘤活性。进一步研究结果表明,利用抑制剂阻断GPR34或能抑制皮下肿瘤模型和结直肠癌肝脏转移模型中的肿瘤生长,此外,将GPR34抑制剂与抗TIGIT抗体结合或能增强肿瘤疗法的疗效。
研究者表示,我们识别出了GPR34或能作为1型先天性淋巴样细胞介导的抗肿瘤免疫的代谢免疫检查点,其或能通过靶向作用1型先天性淋巴样细胞来提供一种开发新型免疫疗法的新策略,从而就能展示治疗对当前免疫疗法反应较差的肝癌和结直肠癌的强大潜力。综上,本文研究结果表明,操控1型先天性淋巴样细胞或能诱导强大的抗肿瘤免疫,而且GPR34或能作为一种新型的代谢免疫检查点,从而有望被靶向作用来开发基于1型先天性淋巴样细胞的新型免疫疗法。(生物谷Bioon.com)
参考文献:
Yan, J., Zhang, C., Xu, Y. et al. GPR34 is a metabolic immune checkpoint for ILC1-mediated antitumor immunity. Nat Immunol 25, 2057–2067 (2024). doi:10.1038/s41590-024-01973-z
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


