Nature:揭示人类CST-Polα–primase复合物维持端粒模板机制
来源:生物谷原创 2022-08-09 17:00
这些作者还初步了解了Polα-primase如何沿着染色体的长度在其他地方启动DNA的合成。其他科学家们也在修复DNA损伤和DNA复制停滞的位点发现了CST-polα-primase复合物。
在一项新的研究中,来自美国威斯康星大学麦迪逊分校的研究人员描述了一种酶和蛋白相互作用以维持位于染色体末端的保护帽(称为端粒)的方式,这是对人体细胞如何在多次细胞分裂之后保持其DNA的完整性的一种新认识。相关研究结果近期发表在Nature期刊上,论文标题为“Structures of the human CST-Polα–primase complex bound to telomere templates”。

DNA复制对于延续我们所知的生命是至关重要的,但是这个过程的许多复杂性---许多生物分子如何到达它们需要去的地方并在一系列错综复杂的协调步骤中相互作用---仍然是神秘的。
论文通讯作者、威斯康星大学麦迪逊分校生物化学助理教授Ci Ji Lim说,“这种称为Polα-primase的酶发挥作用的机制几十年来一直令人费解。我们的研究在理解染色体末端的DNA合成方面取得了重大突破,它提出了关于Polα-primase---DNA复制机器中的核心齿轮---如何运作的新假设。”
每次细胞分裂时,位于构成一条染色体的长链DNA分子末端的端粒会稍微缩短。端粒对染色体的保护就像绳花(aglet)对鞋带末端的保护。最终,端粒变得如此之短,以至于染色体上的重要遗传代码被暴露出来,细胞无法正常运作,进入了僵尸状态。细胞的日常维护的一部分包括通过使用Polα-primase补充这种DNA来防止端粒过度缩短。
在端粒的合成位点,Polα-primase首先建立一个短的核酸引物(称为RNA),然后用DNA延长这个引物(称为RNA-DNA引物)。科学家们之前认为, Polα-primase当从RNA合成切换到DNA分子合成时,需要改变它的形状。Lim实验室发现,Polα-primase使用一种刚性支架在端粒复制机器的另一个齿轮---一种称为CST的辅助蛋白---的帮助下在端粒上合成RNA-DNA引物。CST的作用就像一个停止的标志,它停止了其他酶的活动,并把Polα-primase带到了合成位点。
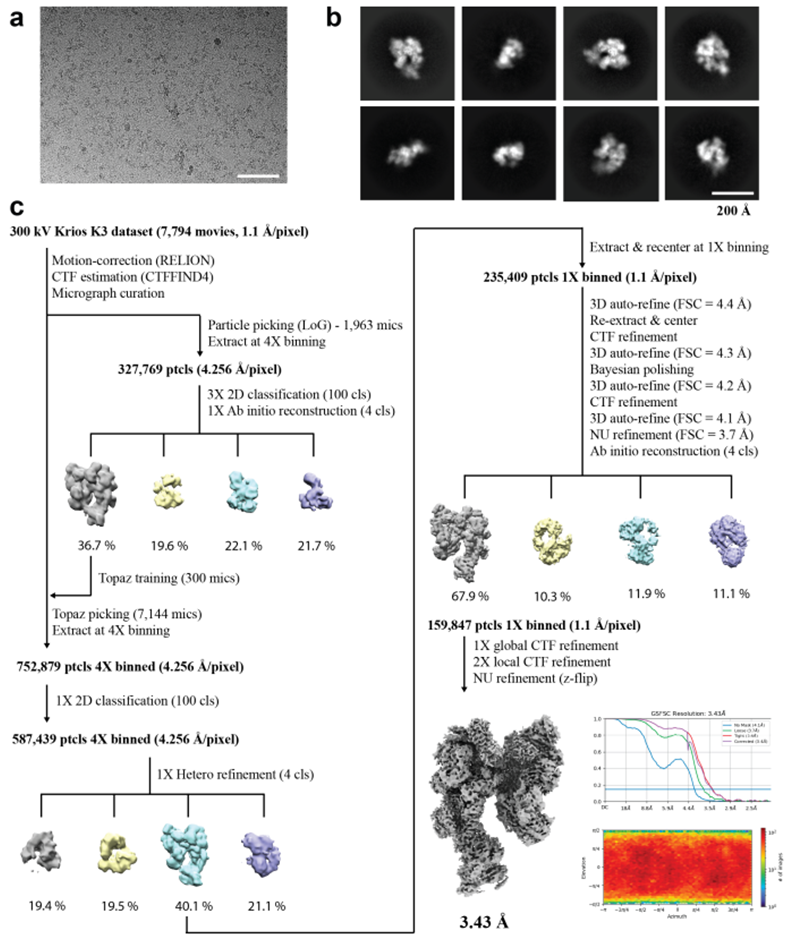
图片来自Nature, 2022, doi:10.1038/s41586-022-05040-1。
Lim说,“在这项研究之前,我们不得不想象Polα-primase如何发挥作用以完成染色体末端的端粒复制。如今,我们有了Polα-primase与一种叫做CST的附属蛋白结合在一起时的高分辨率结构。我们发现在CST与端粒的模板DNA链结合后,它促进了Polα-primase的行动。这样一来,CST为Polα-primase首先合成RNA,然后利用一种统一的支架平台合成DNA搭建了舞台。”
这些作者还初步了解了Polα-primase如何沿着染色体的长度在其他地方启动DNA的合成。其他科学家们也在修复DNA损伤和DNA复制停滞的位点发现了CST-polα-primase复合物。
Lim说,“因为Polα-primase在端粒和染色体的其他地方的DNA复制中起着核心和非常重要的作用---它是唯一一种在DNA模板上从头开始为DNA复制合成引物的酶,我们的CST-Polα-primase结构为Polα-primase如何在基因组DNA复制期间也能完成它们的工作提供了新的见解。这是自然界为完成这一复杂过程而进化出的一个非常优雅的解决方案。”
论文第一作者、威斯康星大学麦迪逊分校生物物理学研究生项目的研究生Qixiang He解释说,“我们的发现揭示了CST在促进这种Polα-primase活动中发挥的前所未有的作用。看看参与染色体其他地方的DNA复制的辅助因子是否像CST对端粒所做的那样招募Polα-primase,这将是很有趣的。”
这些作者使用一种叫做低温电镜单颗粒分析的先进成像技术确定了CST-Polα-primase的结构模型。在低温电镜中,快速冷冻的样品悬浮在一层薄薄的冰膜中,然后用透射电镜进行成像,产生高分辨率的生物大分子---比如这些在DNA复制中起作用的酶---的三维模型。
Lim团队使用低温电镜单颗粒分析,首先确定了CST-Polα-primase的结构,然后更详细地观察该复合物的移动部分。他们在华盛顿大学麦迪逊分校生物化学系的美国国家低温电镜设施收集数据。
论文共同作者Xiuhua Lin说,“我们的生化检测开始时有一个难题,但是一旦我们对CST-pol-α-primase复合物进行成像并看到它的低温电镜结构,一切都立即变得清晰。这让我们团队中的每个人都感到非常满意。除此之外,这些结构还提供了一些想法,我们现在可以设计实验来进行测试。”
这些想法中包括更详细地捕捉CST-pol-α/primase如何发挥作用。这些作者还想绘制人类端粒完整复制过程,而且他们正在研究一旦端粒的DNA被复制,CST-pol-α/primase如何终止它自身的活动。
Lim说,“你不能通过观察一个汽车的单个部件来真正研究它是如何移动的---你必须把这些部件组装起来,观察它们是如何一起发挥作用的。但生物分子复合物往往有许多移动部件,以至于难以研究。这就是低温电镜单颗粒分析的力量和多功能性的作用所在。这种方法使我们能够建立一种高分辨率的原子模型,并对它的移动方式提供了关键的见解,这反过来又促进了我们对人类CST-Polα-primase如何发挥作用的理解。”(生物谷 Bioon.com)
参考资料:
Qixiang He et al. Structures of the human CST-Polα–primase complex bound to telomere templates. Nature, 2022, doi:10.1038/s41586-022-05040-1.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


