Nature子刊:施一公团队揭示人源剪接体识别pre-mRNA分支位点的分子机制
来源:生物世界 2024-01-10 11:54
该研究为理解剪接体的早期组装过程以及分支位点的识别和选择机制提供了重要的结构信息,同时也为与癌症相关的SF3B1突变的致病机制提供了新的见解。
西湖大学施一公团队在 Nature 子刊 Nature Structural & Molecular Biology 发表了题为:Structural Insights into Branch Site Proofreading by Human Spliceosome 的最新研究论文。
该研究报道了人源17S U2 snRNP复合物和剪接体pre-A复合物的高分辨率结构,并结合生化和功能实验,揭示了剪接体进行分支位点选择、校正的分子机制。

在这项最新研究中,研究团队首先通过PRP5上引入的Flag标签纯化出内源的17S U2 snRNP并解析了整体分辨率达到2.5 Å的电镜结构。随后通过使用exon-definition的pre-mRNA底物和小分子抑制剂spliceostatin A(SSA),成功组装并捕获了一个介于E和A complex中间的反应状态,命名为pre-A复合物。Pre-A复合物主要包含两个区域:U2 snRNP区域和U1 snRNP区域。其中U1 snRNP非常柔性,未能解析到较高的分辨率,而U2 snRNP区域整体分辨率达到3Å,可以搭建原子模型(图1)。
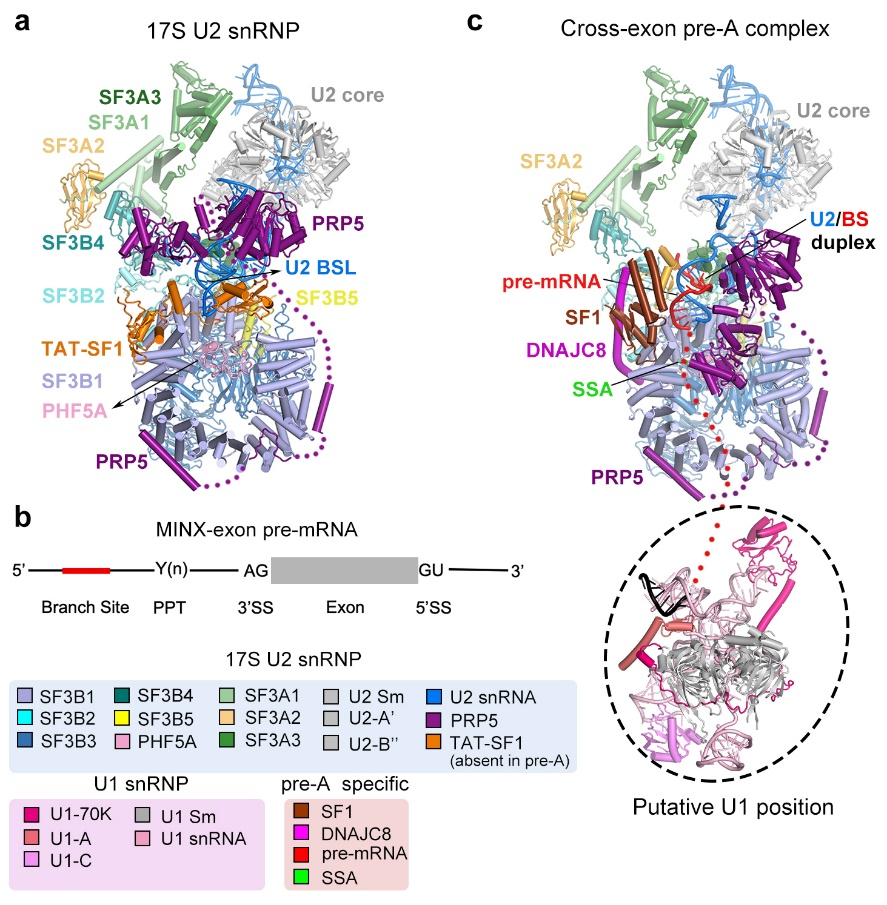
图1: 17S U2 snRNP和pre-A复合物的电镜结构
在17S U2 snRNP中PRP5主要通过其N端锚定在SF3B1外围,其中acidic loop占据了SF3B1的RNA通道,而它的解旋酶结构域结合在U2 snRNA附近。剪接因子TAT-SF1通过其Linker domain将U2 snRNA的BS-interacting stem loop (BSL)包裹起来,从而避免BSL过早打开以及结合分支位点。有意思的是,在pre-A复合物中,SF3B1仍然处于开放状态,PRP5的acidic loop依然结合在SF3B1的RNA通道中,但其解旋酶结构域却发生了显著的构象变化。与之相应的,TAT-SF1从复合物中解离,并且U2 snRNA和pre-mRNA通过部分碱基互补配对,形成了一个初始的双链结构(initial U2/BS duplex)。剪接因子SF1和DNAJC8稳定了局部的构象。
同先前报道的剪接反应抑制剂E7107一样, SSA也结合在SF3B1和PHF5A形成的铰链口袋(hinged pocket)中。不同的是,SSA与PHF5A第26位的半胱氨酸形成了共价键。由于SSA的结合,分支位点腺苷(BS-A)无法进入铰链口袋而游离在外面。与此同时,分支位点下游的多聚嘧啶区(polypyrimidine tract,PPT)也没有替换PRP5的acidic loop结合到SF3B1的RNA通道中。据此,研究人员推测,BS-A进入铰链口袋是诱发SF3B1从开放到关闭构象变化的初始条件,而伴随着SF3B1的构象变化,PRP5、SF1以及DNAJC8都会发生解离,SF3B1紧紧包裹住pre-mRNA,从而完成U2 snRNP对分支位点的选择,形成A complex (图2)。在这个过程中, PRP5的acidic loop与PPT竞争结合SF3B1的RNA通道是PRP5行使其校正功能的关键。

图2: 17S U2 snRNP到A complex过程中的结构变化以及PRP5校正U2/BS duplex的模型图
值得一提的是,该研究发现,PRP5的acidic loop与SF3B1的结合界面上,分布着大量与癌症相关的突变位点。结合先前对PRP5功能和癌症患者中剪接异常现象的研究,研究人员推测这些突变可能是通过削弱PRR5的结合,影响其对分支位点的校正功能,进而引发剪接异常,导致疾病的发生。进一步的生化和RNA-seq数据支持了这种观点。
总的来说,该研究为理解剪接体的早期组装过程以及分支位点的识别和选择机制提供了重要的结构信息,同时也为与癌症相关的SF3B1突变的致病机制提供了新的见解。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


