Sci Signal: 骨髓细胞来源次氯酸分子通过旁效应刺激抑制肿瘤的早期发展
来源:本站原创 2021-04-18 02:37
髓系细胞(MDC)分泌的过氧化物酶(MPO)系统是细胞先天免疫的关键。MDC激活后,MPO分泌到吞噬体内并催化次氯酸(HOCl)的产生,次氯酸是一种有效的氧化剂,然而其在肿瘤免疫中的作用目前仍不清楚。在最近一项研究中,来自美国MD安德森癌症中心的David Piwnica-Worms团队证明了MPO-HOCl系统在老年小鼠的黑色素瘤早期阶段中具有抵抗肿瘤生长
2021年4月18日讯/生物谷BIOON/---髓系细胞(MDC)分泌的过氧化物酶(MPO)系统是细胞先天免疫的关键。MDC激活后,MPO分泌到吞噬体内并催化次氯酸(HOCl)的产生,次氯酸是一种有效的氧化剂,然而其在肿瘤免疫中的作用目前仍不清楚。在最近一项研究中,来自美国MD安德森癌症中心的David Piwnica-Worms团队证明了MPO-HOCl系统在老年小鼠的黑色素瘤早期阶段中具有抵抗肿瘤生长的作用。相关结果发表在《Science Signaling》杂志上。

(图片来源:www.pixabay.com)
髓过氧化物酶(MPO)是在骨髓细胞(MDC)中表达的主要含血红素的酶。 MPO是嗜中性粒细胞嗜酸性颗粒中含量最高的蛋白质产物(5%),约占单核细胞蛋白质的1%,并存在于其他多形核白细胞和巨噬细胞的溶酶体中。 MPO对细胞固有免疫和吞噬细胞的杀微生物活性至关重要,而MPO失调则与许多疾病的发病机制有关,例如类风湿性关节炎,动脉粥样硬化,肾小球损伤,肺纤维化,阿尔茨海默氏病,帕金森氏病和某些癌症。在MDC激活后,MPO主要催化过氧化氢和氯离子转化为次氯酸(HOCl)(一种有效的氯化氧化剂),并在较小程度上催化其他反应性物质,例如次溴酸,次硫氰酸,酪氨酰基和活性氮中间体。
MDC被认为是先天免疫系统的主要介体,并且是人类中最丰富的免疫细胞群。一些研究表明,中性粒细胞等骨髓亚群的耗竭会降低肿瘤的生长,而另一些研究表明,嗜中性粒细胞向肿瘤的募集受损会导致癌症进展的增加。复杂的肿瘤免疫信号网络的分子细节正在研究中,特别是在MDC的肿瘤调控及其将其重新训练为免疫抑制种群方面,例如肿瘤相关的巨噬细胞(CD11b + F4 / F80hiLy6CloLy6G-CD115hi),肿瘤相关的中性粒细胞(CD11b + Ly6GhiLy6Clo) 和髓样来源的抑制细胞(MDSCs; CD11b + Ly6G-Ly6Chi))。肿瘤进展过程中免疫细胞浸润和动态变化的概念已得到证实。但是,对这些MDC在早期肿瘤发展过程中影响肿瘤细胞信号传导和生长的生物学机制知之甚少。
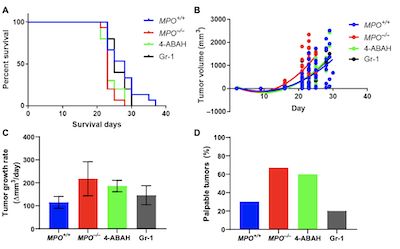

(图1,MPO缺陷促进黑色素瘤的生长)
同样,据报道,由MDC表达的MPO-HOCl系统的作用存在矛盾:一些研究表明HOC1可通过肿瘤细胞的细胞毒性而导致肿瘤消退,而另外一些研究则表明HOC1可引起DNA损伤,从而导致促进肿瘤进展的遗传突变。然而,目前对肿瘤免疫微环境(TIME)中信号网络的理解受到相关免疫功能模型限制。为此,作者建立了小鼠体内实时成像系统,从而能够在肿瘤发生的不同阶段观测HOC1的分泌与功能,进而为其生物学机制提供更多见解。
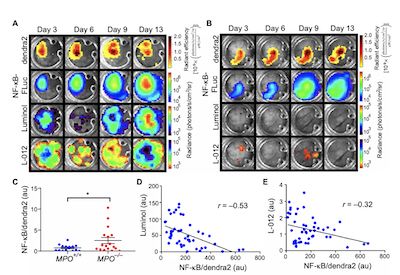

(图2,MOP缺陷促进黑色素瘤细胞NF-kB信号激活)
研究表明:HOC1作为一种旁分泌效应子,将MDC MPO酶活性与周围肿瘤细胞NF-κB联系起来。与具有年龄匹配的同系MPO-/-小鼠相比,具有免疫功能的MPO + / +宿主小鼠中原位黑素瘤的生长更为缓慢。体内和细胞共培养物中的实时活体肿瘤成像显示MDC来源的MPO酶活性与肿瘤细胞中配体诱导的IκBα降解受阻之间存在细胞-细胞邻近依赖性关联。 HOC1的直接转移能够抑制肿瘤细胞中的IκB激酶(IKK)活性,从而降低NF-κB的转录激活与下游代谢途径的诱导,细胞周期进程和DNA复制中涉及的基因表达的变化。相比之下,HOC1诱导了CD8 + T细胞中与离子转运以及与T细胞活化相关的MAPK和PI3K-AKT信号通路相关的转录变化。 MPO增加了吸引髓样细胞的细胞因子CXCL1和CXCL5的循环浓度,增强了CD8 +细胞毒性T细胞的局部浸润,并降低了肿瘤的生长。
总体而言,这些数据揭示了MDC衍生的HOCl作为小分子旁分泌信号转导因子的作用,该信号转导抑制黑色素瘤肿瘤细胞中的IKK,在早期肿瘤进展过程中介导抗肿瘤反应(生物谷 Bioon.com)
原始出处:Tracy W. Liu, Seth T. Gammon, Ping Yang et al., Myeloid cell–derived HOCl is a paracrine effector that trans-inhibits IKK/NF-κB in melanoma cells and limits early tumor progression. Science Signaling 06 Apr 2021:Vol. 14, Issue 677, eaax5971 DOI: 10.1126/scisignal.aax5971
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


