《科学》子刊:肺癌相关成纤维细胞这把双刃剑,是促进耐药还是促进药敏,因人而异
来源:奇点糕 2022-10-20 09:01
研究人员在实验中发现,肿瘤相关成纤维细胞对肺癌细胞药物反应的影响因肺癌亚型和药物的不同而不同。
非小细胞肺癌(NSCLC)是肺癌最常见的病理类型,约占肺癌病例的85%。NSCLC常见的基因突变主要包括EGFR突变、KRAS突变和EML4-ALK融合基因等[1],使得NSCLC的治疗充满异质性。
在亚洲,50%以上的NSCLC患者EGFR被突变激活,抑制EGFR能大大改善患者预后。然而,EGFR突变型肺癌患者使用EGFR抑制剂后,往往会出现耐药。究其原因,除了治疗过程中EGFR产生二次点突变外,还存在旁路激活途径弥补被抑制的EGFR通路[2]。
肿瘤相关成纤维细胞(CAF)是肿瘤微环境中关键的细胞成分,由正常的成纤维细胞(NAF)经肿瘤细胞作用后转化形成。和NAF相比,CAF能分泌一些特别的细胞因子及细胞外基质,作用于肿瘤细胞,调控肿瘤细胞的增殖、转移和耐药等恶性生物学行为[3]。
近日,由南佛罗里达大学Uwe Rix领衔的团队,发现CAF并非那么简单,在诱导某些肺癌耐药的同时,居然会促进EGFR突变肺癌对药物敏感。相关论文发表于著名科学期刊Science signaling上[4]。
研究人员对CAF促药敏的机制进行探究,发现和NAF相比,CAF由于分泌的细胞因子IGF减少,IGFBP增加,对EGFR突变型肺癌细胞的IGF1R和整合素的激活作用减弱,抑制了IGF1R介导的IRS2/AKT信号和整合素介导的FAK/ERK信号,从而增强EGFR抑制剂的药效。

官网论文首页截图
为了研究成纤维细胞对NSCLC的影响,研究人员分别把各亚型NSCLC细胞与CAF或NAF共培养。无论是CAF还是NAF,都能促进KRAS突变肺癌细胞和EML4-ALK融合阳性肺癌细胞对相应的药物产生耐药,而且CAF的促耐药作用更强。但对于EGFR突变肺癌细胞,CAF却能抑制耐药,增强EGFR抑制剂的药效,而NAF毫无影响。
这截然相反的结果提示,CAF对肺癌细胞药物反应的影响,究竟是促耐药还是促药敏,因细胞和药物而异。
研究人员对CAF的促药敏效应产生了兴趣,分别使用CAF和NAF培养基的上清液处理肺癌细胞,发现只有CAF来源的上清液能促进EGFR抑制剂对EGFR突变肺癌细胞的促凋亡作用,提示CAF可能通过分泌的某些蛋白,增强肺癌细胞对药物的敏感性,发挥抑癌作用。
对CAF表达分泌的蛋白进行分析,研究人员发现,和NAF相比,CAF的胰岛素样生长因子(IGF)表达下调,分泌的胰岛素样生长因子结合蛋白(IGFBP)增多。
既往研究发现,IGF/IGF1R信号与肺癌EGFR抑制剂耐药有关[5]。IGF与表达于肺癌细胞表面的受体IGF1R结合,IGF1R激活后活化IRS2/PI3K/AKT等通路,促进肺癌细胞存活,对抗EGFR抑制剂的抑制。IGFBP能与IGF1R竞争结合IGF,从而避免激活IGF1R。
据此,研究人员推测,CAF可能通过下调IGF的表达,同时增加IGFBP的分泌,从而抑制肺癌细胞IGF1R的激活,增强EGFR突变细胞对EGFR抑制剂的敏感性。
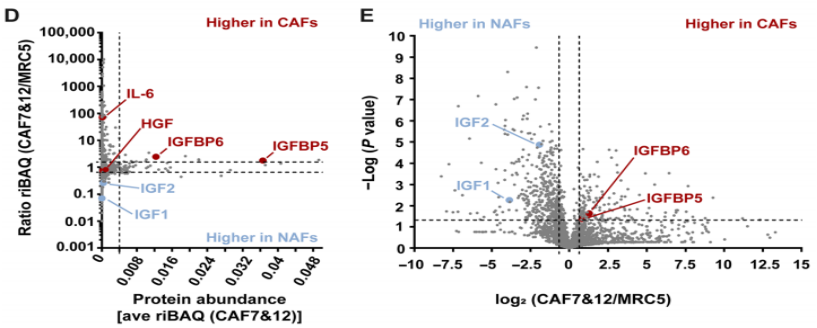
相比于NAF,CAF表达IGF下调,分泌IGFBP增多
接下来,研究人员运用实验对假说进行了验证。
EGFR突变型肺癌细胞经过IGF处理后,即便在EGFR抑制剂存在的环境里,细胞活力依旧明显。而添加IGFBP,则能明显增强肺癌细胞对EGFR抑制剂的反应,促进凋亡。这表明,IGF促进肿瘤,IGFBP抑制肿瘤,CAF通过调节它们来促进肺癌细胞对药物致敏。
激酶实验发现,无论CAF是否存在,EGFR突变肺癌细胞的EGFR自体磷酸化和下游磷酸化水平都被EGFR抑制剂强烈降低,提示CAF的促药敏作用不是通过EGFR直接传导信号。
与此同时,研究人员发现,经CAF的培养基上清液处理后,EGFR突变肺癌细胞的蛋白IRS2、AKT、FAK1和ERK1/2磷酸化水平都显著降低。
我们都知道,IRS2磷酸化后能激活PI3K/AKT通路[6],FAK1被整合素磷酸化后启动ERK通路[7],p-AKT和p-ERK对于细胞的存活和增殖至关重要。
因此,这些数据表明,CAF促进EGFR突变型肺癌细胞对药物的敏感性,是通过抑制细胞的IGF1R和FAK信号来完成。
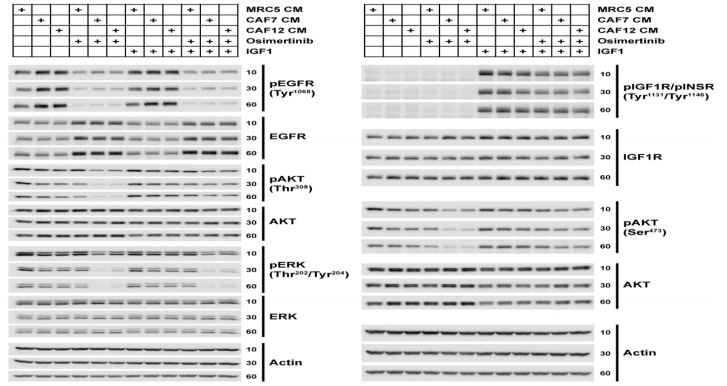
CAF抑制EGFR突变型肺癌细胞的IGF1R和FAK信号
最后,研究人员探讨了双重靶向IGF1R和FAK信号对增强肺癌药敏的治疗作用。
在体外实验中,研究人员先使用IGF1R抑制剂处理EGFR突变型肺癌细胞,验证了抑制IGF1R对EGFR抑制剂活性的增强作用,接着,使用小分子抑制剂联合靶向IGF1R和FAK,更大大增强了EGFR抑制剂的药效。长期的克隆形成实验显示,联用IGF1R、FAK和EGFR抑制剂具有强大的协同作用,几乎能完全消灭EGFR突变细胞。
在体内实验中,靶向EGFR、IGF1R和FAK,联合用药显著延缓了EGFR突变肺癌小鼠肿瘤的生长,降低瘤体的大小和重量,同时对小鼠体重的影响轻微,表明这种药物组合不仅持久有效,而且安全耐受。
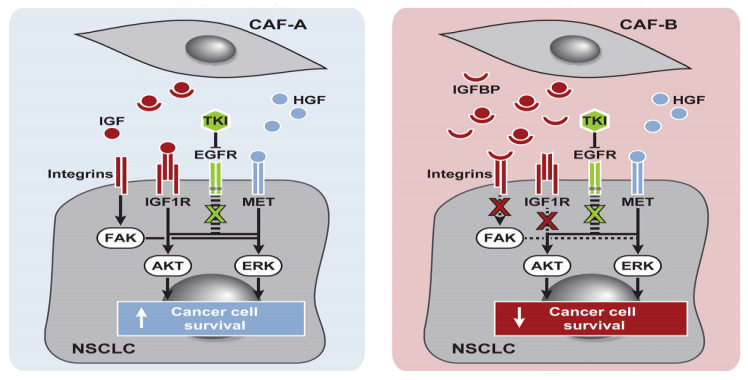
CAF促进EGFR突变肺癌细胞对EGFR抑制剂敏感的机制示意图
综上所述,研究人员在实验中发现,肿瘤相关成纤维细胞对肺癌细胞药物反应的影响因肺癌亚型和药物的不同而不同。对于EGFR突变型肺癌,CAF旁分泌的促癌细胞因子IGF减少,抗癌蛋白IGFBP增多,减弱了对IGF1R和整合素的激活,抑制了IGF1R介导的IRS2/AKT信号和整合素介导的FAK/ERK信号,从而增强EGFR抑制剂的药效。
研究人员还以CAF促药敏的机制为靶标,证明了在抑制EGFR的同时靶向IGF1R和FAK的联合用药对于EGFR突变肺癌的卓越疗效。
这项研究不仅加深了我们对CAF在肿瘤微环境中的作用的理解,还提出了一个消除肺癌耐药的治疗策略,有望为EGFR抑制剂在临床中的应用打开一个新的局面。
参考文献
[1] Warth A, Penzel R, Lindenmaier H, et al. EGFR, KRAS, BRAF and ALK gene alterations in lung adenocarcinomas: patient outcome, interplay with morphology and immunophenotype. Eur Respir J. 2014;43(3):872-883. doi:10.1183/09031936.00018013
[2] Rotow J, Bivona TG. Understanding and targeting resistance mechanisms in NSCLC. Nat Rev Cancer. 2017;17(11):637-658. doi:10.1038/nrc.2017.84
[3] Chen C, Hou J, Yu S, et al. Role of cancer-associated fibroblasts in the resistance to antitumor therapy, and their potential therapeutic mechanisms in non-small cell lung cancer. Oncol Lett. 2021;21(5):413. doi:10.3892/ol.2021.12674
[4] Remsing Rix LL, Sumi NJ, Hu Q, et al. IGF-binding proteins secreted by cancer-associated fibroblasts induce context-dependent drug sensitization of lung cancer cells. Sci Signal. 2022;15(747):eabj5879. doi:10.1126/scisignal.abj5879
[5] Liu Q, Yu S, Zhao W, Qin S, Chu Q, Wu K. EGFR-TKIs resistance via EGFR-independent signaling pathways. Mol Cancer. 2018;17(1):53. Published 2018 Feb 19. doi:10.1186/s12943-018-0793-1
[6] Landis J, Shaw LM. Insulin receptor substrate 2-mediated phosphatidylinositol 3-kinase signaling selectively inhibits glycogen synthase kinase 3β to regulate aerobic glycolysis. J Biol Chem. 2014;289(26):18603-18613. doi:10.1074/jbc.M114.564070
[7] Li X, Liu J, Sun H, et al. SRPX2 promotes cell proliferation and invasion via activating FAK/SRC/ERK pathway in non-small cell lung cancer. Acta Biochim Pol. 2020;67(2):165-172. doi:10.18388/abp.2020_5158
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


