生物生必看!1篇Cell+1篇Cell子刊揭秘基因拷贝在复制过程中如何黏连在一起
来源:生物谷原创 2025-09-30 10:06
克里克研究所 John Diffley 和 Frank Uhlmann 团队通过《细胞》和《分子细胞》发表的两篇研究,终于用生物化学重构和单分子成像技术,揭开了这一细胞分裂核心谜题的面纱。
在细胞分裂前,DNA 会精准复制出两份相同的 "姐妹染色单体",它们被环状的黏连蛋白(cohesin)紧紧束缚,直到分裂时被纺锤丝拉向细胞两极—— 这一过程如同一场精密的 "微型拔河"。
黏连蛋白虽在近 30 年前就被发现,但一个关键问题始终困扰着科学家:负责 DNA 复制的 "复制体"(replisome),遇到路径上的黏连蛋白环时,究竟如何顺利通过而不破坏遗传信息的完整性?如今,克里克研究所 John Diffley 和 Frank Uhlmann 团队通过《细胞》和《分子细胞》发表的两篇研究,终于用生物化学重构和单分子成像技术,揭开了这一细胞分裂核心谜题的面纱。
Diffley 团队长期聚焦 DNA 复制机制,而 Uhlmann 团队则深耕黏连蛋白调控细胞分裂的功能,直到双方的技术突破让合作成为可能。"我们此前从未研究过黏连蛋白,一直专注于解析复制体的组成元件,"Diffley 说,"而 Uhlmann 团队在理解黏连蛋白如何组织 DNA 方面积累了深厚基础,恰好我们同时具备了探索两者相互作用的条件。" 这场跨领域合作的关键,在于博士研究员 Samson Glaser 和博士后 Minamino Masashi 开发的 "生物重构" 实验——他们在试管中重现了 DNA 复制与黏连蛋白相互作用的全过程,并通过荧光标记实现了实时观察。


从理论上看,黏连蛋白环直径约 35nm,而复制体直径约 25nm,看似足以容纳复制体通过。但此前研究发现,即使是直径仅 10nm 的 DNA 结合蛋白,都可能阻碍黏连蛋白滑动,这暗示黏连蛋白在 DNA 上可能处于 "折叠压缩" 状态。为验证复制体能否突破这一障碍,Glaser 将荧光标记的黏连蛋白加载到拉直的 DNA 链上,再加入同样带标记的复制体组件。
通过全内反射荧光显微镜(TIRF)观察,他首次捕捉到了复制体穿过黏连蛋白环的实时过程:当复制体靠近时,部分黏连蛋白环会 "舒展" 结构,允许复制体缓慢通过,之后重新恢复环状,继续束缚姐妹染色单体。更令人意外的是,随着复制体组件不断完善(加入 DNA 聚合酶、螺旋酶等),尽管其整体尺寸增大,穿过黏连蛋白环的效率反而从 10% 提升至 40% 以上——这与 "越大越难通过" 的直觉完全相反。
进一步实验发现,这一 "反常" 现象的关键在于两种 DNA 聚合酶:Pol α 和 Pol ε。当移除 Pol α 时,复制体完全无法穿过黏连蛋白环,只能推着黏连蛋白沿 DNA 移动;而缺失 Pol ε 时,通过率显著下降。更有趣的是,即使使用缺乏催化活性、仅保留 C 端结构域的 Pol ε 突变体(Pol ε Δcat),仍能恢复部分通过率,说明 Pol ε 的非催化结构域在辅助复制体穿环中发挥核心作用。"这完全颠覆了我们对 DNA 聚合酶的认知——它们不仅负责合成新 DNA 链,还在协调复制体与黏连蛋白相互作用中不可或缺,"Glaser 解释道。单分子力分析还显示,复制体穿环时会短暂积累不超过 20pN 的张力(远低于黏连蛋白环的断裂阈值),这种张力可能帮助黏连蛋白从折叠状态舒展,为复制体开辟通道。
不过,复制体穿环并非总能完美完成。Minamino 通过更精细的生物化学实验发现,约半数情况下,黏连蛋白在与复制体相遇后,只会环抱住其中一条姐妹染色单体,这暗示黏连蛋白环可能在碰撞中短暂 "破裂",随后仅重新包裹单条 DNA。但细胞有应对这种 "失误" 的补救机制:一种名为 "黏连蛋白装载器"(Scc2-Scc4 复合物)会及时介入,将另一条姐妹染色单体 "拉" 进黏连蛋白环,完成双染色单体的束缚。此外,研究还发现了第二种保障机制:复制过程中会有新的黏连蛋白被招募到 DNA 上,通过 "两步捕获" 机制(先绑定一条染色单体,再结合另一条)形成新的环状束缚。这两种机制共同确保,即使初始穿环失败,姐妹染色单体也不会在分裂前提前分离。
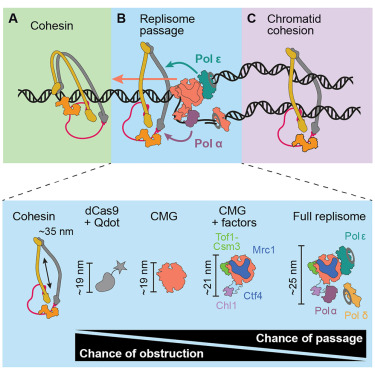
为确认这些体外实验结果的生理相关性,团队还通过酵母细胞验证:当 Pol α 或 Pol ε 的关键结构域突变时,细胞分裂时姐妹染色单体的黏连错误率显著上升,进一步证明 DNA 聚合酶在穿环过程中的必要性。同时,他们发现黏连蛋白的 ATP 酶活性并非穿环必需——使用 ATP 水解缺陷的 EQ 突变体黏连蛋白,复制体仍能正常通过,说明这一过程更多依赖物理结构的动态变化,而非酶促反应。
这些发现不仅解答了长期存在的科学疑问,更开辟了新的研究方向。"我们现在好奇,除了合成 DNA,Pol α 和 Pol ε 的结构域究竟通过何种分子机制辅助穿环,"Diffley 表示。而 Uhlmann 则关注体内场景的复杂性:"既然存在多种黏连保障机制,我们想知道细胞在不同生理状态下(如 DNA 损伤、应激反应)是否会偏好特定方式,这可能与癌症等疾病的染色体不稳定有关。"
正如 Uhlmann 所说:"如果没有结合 DNA 复制和黏连蛋白两大领域的专业知识,我们无法解答这个基础生物学问题。这项工作只有在克里克研究所这样的跨学科环境中才能实现,它真正体现了科学合作的力量。" 未来,对这一过程的深入解析,或许能为理解癌症中染色体分离异常、开发靶向治疗提供新的靶点。(生物谷Bioon.com)
参考文献:
Samson Glaser et al, Replisome passage through the cohesin ring, Cell (2025). DOI: 10.1016/j.cell.2025.08.028.
Masashi Minamino et al, Biochemical reconstitution of sister chromatid cohesion establishment during DNA replication, Molecular Cell (2025). DOI: 10.1016/j.molcel.2025.08.026.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


