2024年12月Science期刊精华
来源:生物谷原创 2025-01-02 11:44
一眨眼,2024年的最后一个月份已经结束,12月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
一眨眼,2024年的最后一个月份已经结束,12月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.意外发现的“兼职”酶!Science:蛋白ALAS1的新作用,意外推动小RNA疗法的新纪元
doi:10.1126/science.adp938
在科学的世界里,有时候最令人沮丧的结果反而成为最大的发现起点。最近,来自纪念斯隆-凯特琳癌症中心和西奈山伊坎医学院的研究人员经历了一次这样的惊喜时刻。他们原本以为,当从细胞中去除一种名为ALAS1的蛋白时,microRNA(微小的调控RNA)水平会下降。但实验结果却完全相反——microRNA竟然增加了!这一违反直觉的发现不仅揭示了ALAS1的一个未被认识的功能,还为改进使用小RNA来沉默致病基因的疗法带来了新的希望。
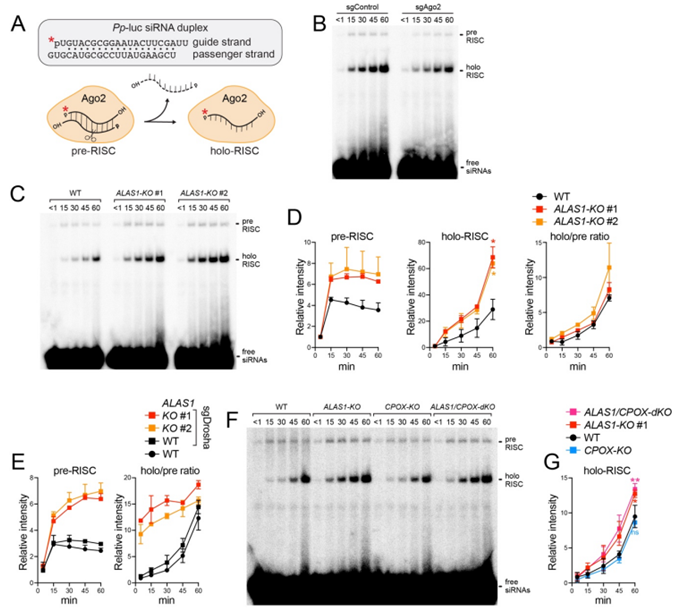
对血红素生物合成突变体中的RISC组装进行表征
如果我们把细胞比作一个繁忙的工厂,那么ALAS1就像是一个技术娴熟的操作员,通常只负责生产线上的某一部分任务——比如血红素的生产。但是,科学家们突然发现,这个操作员还在悄悄地管理着另一条生产线——调节microRNA的生成。
这就是ALAS1的故事。它不仅帮助制造血红素,还在细胞质中扮演了一个全新的角色:通过抑制负责信使RNA(mRNA)降解的成熟Argonaute效应复合物的组装,从而限制microRNA的积累。这种新功能与它在血红素合成中的典型作用无关,就像一位熟练工突然掌握了另一项技能一样让人惊讶。
相关研究结果发表在2024年12月20日的Science期刊上,论文标题为“Noncanonical role of ALAS1 as a heme-independent inhibitor of small RNA–mediated silencing”。
2.类器官助力超级流感疫苗!Science:打破免疫偏见,全面抵御季节性和大流行病毒
doi:10.1126/science.adi2396
如果有一种流感疫苗不仅能抵御每年的季节性流感,还能像哨兵一样防范那些可能引发下一次大流行的新型病毒变种,这听起来是不是很吸引人?最近,斯坦福大学医学院和辛辛那提大学医学院的研究人员带来了一项令人振奋的突破。他们在实验室里开发出一种创新方法,使得人类季节性流感疫苗更加广泛有效。
相关研究结果发表在2024年12月20日的Science期刊上,论文标题为“Coupling antigens from multiple subtypes of influenza can broaden antibody and T cell responses”。
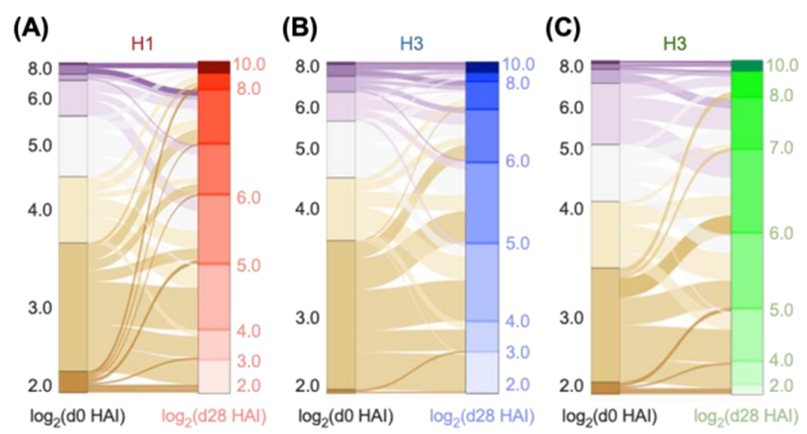
Sankey流程图描述了接种不同疫苗亚型(A) H1、(B) H3和(C) B后每个供体的血清素抑制(HAI)反应变化
为了克服这一挑战,研究人员想出了一个聪明的办法:他们将四种不同流感病毒亚型的血凝素(hemagglutinin)分子连接在一起,形成一个多抗原疫苗。这样,当B细胞——负责生产抗体的免疫细胞——吞噬其中一个抗原时,实际上会吞下整个组合体,并在其表面展示所有四种抗原的片段。这就像是给B细胞提供了多张敌人的照片,确保它们不会错过任何一个目标。这种方法大大提高了免疫系统对所有四种流感病毒亚型产生强烈抗体反应的可能性。
此外,研究人员还测试了加入禽流感病毒血凝素的效果。结果显示,五抗原疫苗构建物显著增强了对禽流感病毒的抗体反应,而不仅仅是温和的反应。这表明,新设计的疫苗不仅可以提高季节性流感的防护效果,还有潜力应对潜在的大流行病原体。
3.Science: 揭示Inc-eRNA通过形成R环塑造情感经验诱导的行为适应机制
doi:10.1126/science.adp1562
在一项新的研究中,来自南卡罗来纳医科大学的研究人报道说,在临床前模型中发现了一种新的基因调控机制,该机制涉及对情绪体验的行为适应。尽管这种适应对生存至关重要,但在某些精神疾病患者中可能会出现问题。了解导致适应不良行为(maladaptive behaviors)的遗传变化可能有助于科学家们开发更好的RNA疗法来治疗脑部疾病。
相关研究结果发表在2024年12月13日的Science期刊上,论文标题为“A long noncoding eRNA forms R-loops to shape emotional experience–induced behavioral adaptation”。论文通讯作者为南卡罗来纳医科大学神经科学系助理教授Makoto Taniguchi博士和神经科学系教授兼系主任Christopher Cowan博士。论文第一作者为南卡罗来纳医科大学博士生Rose Marie Akiki。
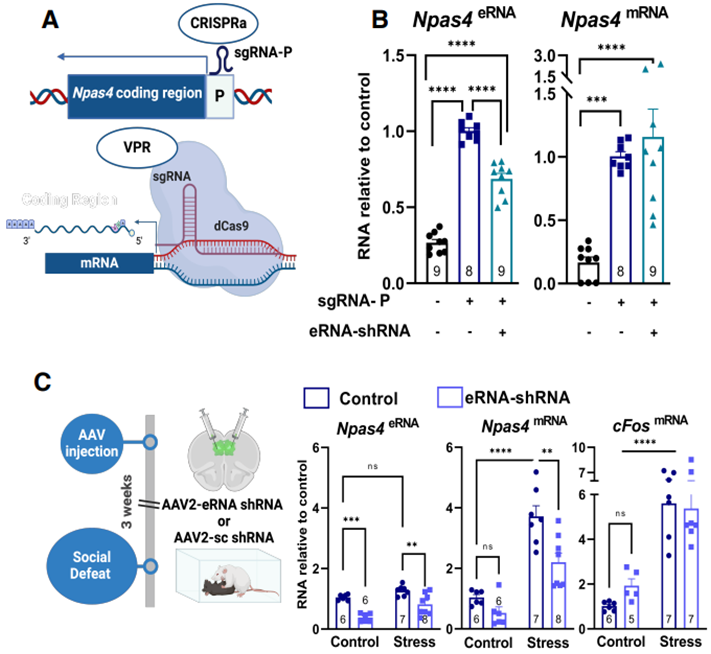
利用CRISPRa和sgRNA-P靶向npas4的启动子区域
在这项新的研究中,这些作者着重关注长链非编码增强子RNA(long non-coding enhancer RNA, Inc-eRNA),这是一种特定类型的lncRNA,与靶基因的调节区域相互作用。在与特定基因结合后,Inc-eRNA可以形成称为R环(R-loop)的独特结构,以帮助控制这些基因。
他们研究了一个名为NPAS4的基因,该基因与压力诱导的快感缺失或曾经令人愉悦的活动缺乏乐趣以及药物诱导的复发有关。他们的研究为R环在控制情绪体验引起的行为变化中的作用提供了第一个证据。
R环可以通过在靶基因的调节区域形成RNA:DNA“三明治”来帮助开启特定的基因。就NPAS4基因而言,R环似乎有助于将包括开启基因指令的增强子区域与基因主体(包括重要的基因启动子区域)连接起来,这使得该基因能够根据经验开启。
4.吃什么可以决定T细胞的命运?Science:揭示不同的营养物决定衰竭的T细胞命运机制
doi:10.1126/science.adj3020
早餐吃炒鸡蛋还是苹果,可能不会决定你这一天的成败。但对于人体内的细胞来说,选择正确的“食物”却能决定它们的命运。在一项新的研究中,来自索尔克研究所的研究人员揭示了营养物和细胞身份之间复杂关系的新框架。相关研究结果发表在2024年12月13日的Science期刊上,论文标题为“Nutrient-driven histone code determines exhausted CD8+ T cell fates”。
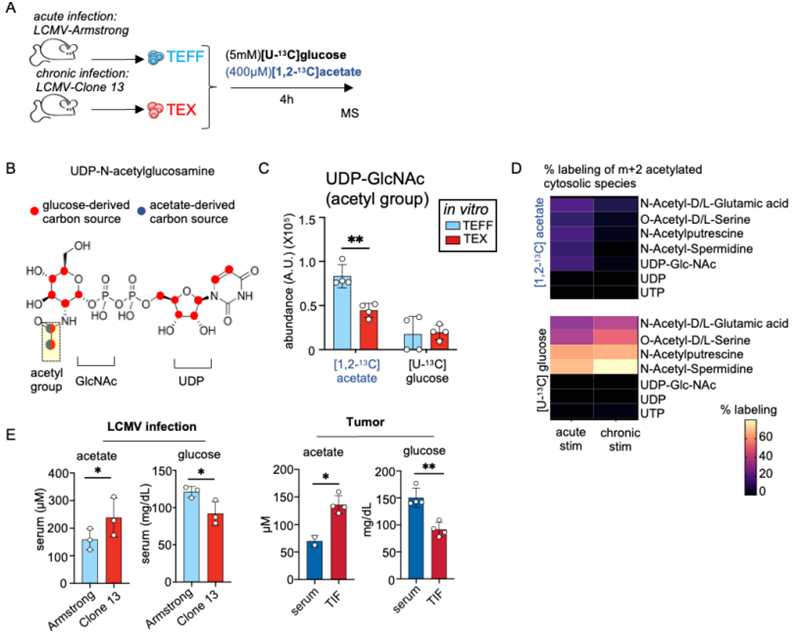
ACSS2和ACLY调节TEFF和TEX细胞之间乙酸和葡萄糖衍生的乙酰辅酶A的产生
这项研究发现,就像人们常说的“你吃什么就是什么”,对于细胞而言,这句话有了全新的科学依据。细胞的功能直接与它们所摄取的营养物联系起来。当科学家们探索不同类型的免疫细胞时,他们发现了营养物偏好对细胞身份的影响——特别是在T细胞中。
免疫系统依赖于专门的“效应”T细胞来对抗病原体,但在像HIV这样的慢性感染或癌症中,这些细胞的持续激活会使它们变成无法继续战斗的“衰竭”T细胞。研究人员发现,从乙酸到柠檬酸的营养物转换在决定T细胞命运方面起着关键作用,可以将活跃的效应T细胞转变为衰竭的T细胞。这一发现不仅解开了科学家们长期以来对营养物偏好如何影响细胞身份的谜团,还为维持免疫功能开辟了新的干预途径。
5.Science:大脑感应T细胞经编程后可将治疗载荷递送到大脑中
doi:10.1126/science.adl4237
目前,对中枢神经系统(CNS)疾病(如脑瘤、神经炎症和神经变性)的治疗仍然具有挑战性,这是因为很难将分子药物有效地递送到大脑中。此外,也很难将这些药物的作用限制在大脑,以避免外周毒性或全身毒性。
免疫细胞在进化过程中渗透到不同的组织中,整合周围环境的信息,重塑组织生态系统。例如,称为T 细胞的免疫细胞可以在健康和致病条件下穿过血脑屏障。这些特性使它们成为中枢神经系统的理想递送工具。从原理上讲,如果人们对细胞进行编程,使其有选择性地自主向大脑递送治疗载荷,就能减少全身性脱靶毒性并提高疗效。
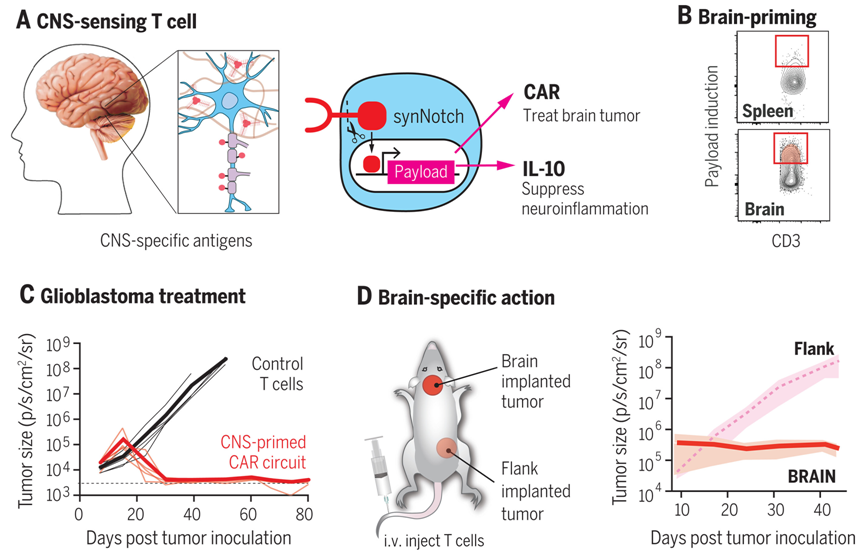
大脑感应T细胞经编程后可将治疗载荷递送到大脑中
在一项新的研究中,来自加州大学旧金山分校的研究人员假设,有可能设计出只以组织特异性方式发挥作用的免疫细胞。利用 T 细胞有选择性地向大脑有效递送载荷的一种方法是,对T 细胞进行改造使之识别正常(非疾病)的中枢神经系统特异性抗原,并利用这一解剖学线索在局部诱导治疗剂产生。这种基于细胞的中枢神经系统特异性递送系统有望作为治疗一系列中枢神经系统疾病的通用平台。
相关研究结果发表在2024年12月6日的Science期刊上,论文标题为“Programming tissue-sensing T cells that deliver therapies to the brain”。
6.Science:新研究揭示细胞RNA直接与MAVS蛋白相互作用,从而促进抗病毒信号转导
doi:10.1126/science.adl0429
在一项新的研究中,来自华盛顿大学和杜克大学的研究人员揭示了细胞自身RNA在抵御RNA病毒攻击方面的新作用。他们发现,细胞的一些RNA分子有助于调节抗病毒信号。这些信号是针对病毒入侵的免疫反应复杂协调的一部分。相关研究结果发表在2024年12月20日的Science期刊上,论文标题为“Cellular RNA interacts with MAVS to promote antiviral signaling”。论文通讯作者为华盛顿大学医学院免疫学教授Ram Savan。论文第一作者为Savan实验室博士后研究员Nandan S. Gokhale。
这些作者写道,“随着RNA越来越多地被视为药物和药物可靶向的靶点,这为利用基于RNA的药物对抗感染和自身免疫开辟了潜力。”
Savan解释说,体内的一些蛋白起着哨兵的作用。当它们检测到RNA病毒的存在时,它们通过线粒体抗病毒信号传转导(mitochondrial antiviral signaling, MAVS)通路激活干扰素。MAVS蛋白位于细胞能量工厂——线粒体——的外膜上。
在细胞中的哨兵蛋白感知到病毒RNA后,MAVS蛋白成为招募其他信号蛋白的平台。由此形成的大型自组装分子复合物被称为信号体(signalosome),它们是促进蛋白-蛋白相互作用和开启免疫信号的蛋白簇。MAVS信号体发出增强的警报命令,激活干扰素和其他抗病毒因子。这些引发了对病毒的各种防御。
7.Science:揭示H5N1血凝素的单个突变可能增加这种病毒感染人体并在人际传播的风险
doi:10.1126/science.adt0180
禽流感病毒通常需要几个突变才能适应并在人类中传播,但当一个突变就会增加成为大流行病毒的风险时,会发生什么?
来自斯克里普斯研究所的科学家们领导的一项新研究表明,最近感染美国奶牛的H5N1“禽流感”病毒中的一个突变可能会增强这种病毒附着在人类细胞上的能力,从而可能增加人与人之间传播的风险。这一研究结果强调了监测H5N1进化的必要性。
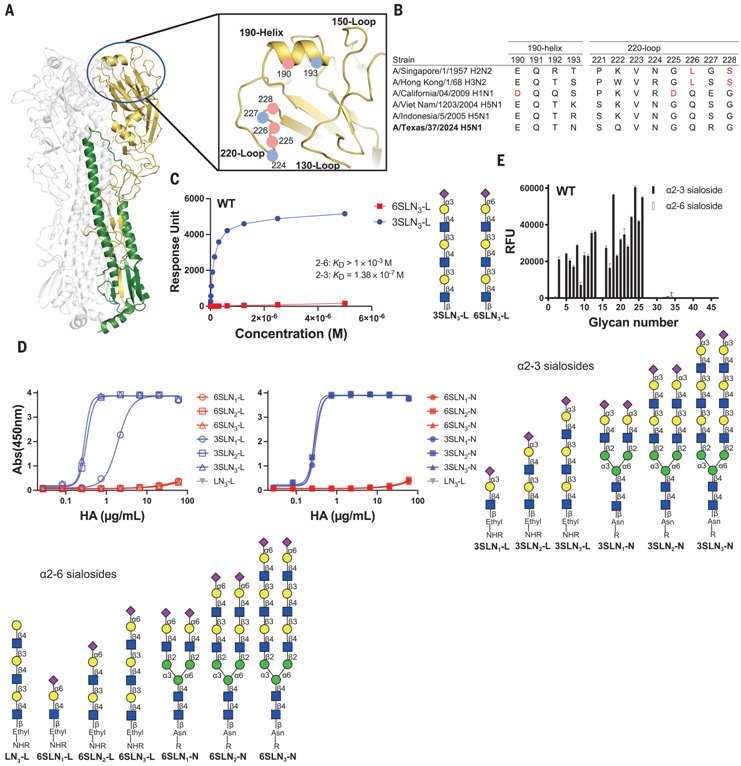
野生型A/Texas/37/2024 (H5N1)血凝素的受体表征
相关研究结果发表在2024年12月6日的Science期刊上,论文标题为“A single mutation in bovine influenza H5N1 hemagglutinin switches specificity to human receptors”。
目前,没有记录在案的H5N1人际传播病例:人类感染禽流感病毒病例与密切接触受污染环境以及受感染的鸟类(包括家禽)、奶牛和其他动物有关。然而,公共卫生官员担心禽流感病毒有可能进化到在人与人之间有效传播,这可能会导致一场新的、可能致命的流行病。
8.从“苹果树的智慧”到体内蛋白监测!Science:开发出一种植入式抖动传感器,可持续监测体内的炎症蛋白标志物
doi:10.1126/science.adn2600
在一项新的研究中,来自美国西北大学的研究人员设计了一种创新的可植入设备,能够实时监测体内蛋白水平的变化。这种设备灵感来源于自然现象——摇动苹果树让成熟的果实落下。研究人员巧妙地将这一概念应用到了生物传感领域,通过一种由粘附在蛋白上的DNA链组成的装置,“抖落”这些蛋白,然后抓住新的蛋白进行测量。这项技术为跟踪炎症等关键蛋白标志物提供了前所未有的能力。

频率对二茂铁峰的影响
相关研究结果发表在2024年12月6日的Science期刊上,论文标题为“Active-reset protein sensors enable continuous in vivo monitoring of inflammation”。该设备的成功开发意味着我们可以像连续血糖监测仪一样,实时了解体内的蛋白波动情况。论文通讯作者、西北大学的Shana O. Kelley教授说:“就像你可以在手臂上佩戴一个设备来监测血糖水平一样,我们现在也能实时观察体内炎症相关的蛋白变化。”
Kelley教授解释道:“我们需要跟踪这些波动,以便全面了解体内发生的情况。这是一种全新的能力——能够实时观察炎症。我们现在开始探索大量的应用。”她提到,虽然已经有许多传感器可以连续检测小分子如葡萄糖或电解质,但设计能够检测更大、更复杂的蛋白分子的传感器更具挑战性。传统的DNA受体一旦与目标蛋白结合,就会非常牢固,有时甚至可以保持超过20个小时,这使得它们无法捕捉到血液中的实时变化。
9.Science:利用合成抑制 T 细胞在局部实现免疫抑制,有望治疗一系列炎症性疾病
doi:10.1126/science.adl4793
许多治疗炎症或自身免疫性疾病的方法都会造成全身免疫抑制,从而导致严重的慢性毒性。如果能仅在靶组织或移植器官中局部抑制免疫反应,就有可能克服这些全身毒性,治疗多种炎症性疾病。
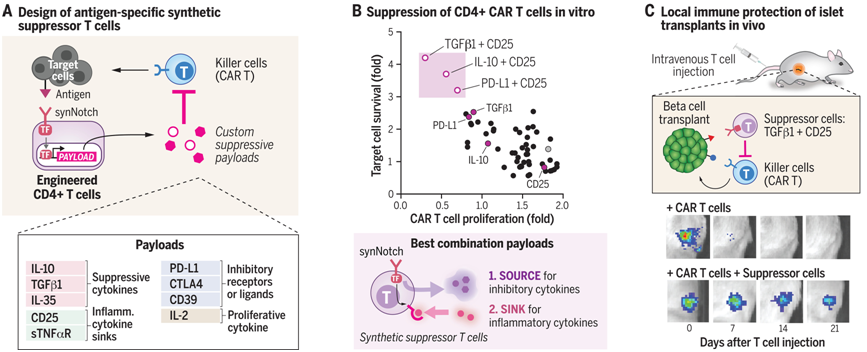
工程化的合成抑制T细胞执行局部靶向免疫保护程序
基于细胞的疗法原则上可以通过编程在局部保护组织免受免疫攻击,而无需全身免疫抑制。为了产生靶向抑制细胞(suppressor cell),人们可能会重新定向内源性细胞,如调节性 T 细胞或髓样抑制细胞,以识别疾病部位。不过,在一项新的研究中,来自加州大学旧金山分校的研究人员采用了一种重组方法,即通过工程改造传统的 CD4+ T 细胞,使其发挥合成抑制细胞的功能,从而系统地探索免疫抑制的基本要求。相关研究结果发表在2024年12月6日的Science期刊上,论文标题为“Engineering synthetic suppressor T cells that execute locally targeted immunoprotective programs”。
10.Science:机体神经元保护的性别差异或有望揭示阿尔兹海默病的新型疗法靶点
doi:10.1126/science.adk7844
阿尔兹海默病(AD)和其它与脱髓鞘相关的年龄相关疾病往往会表现出一定的性别差异。近日,一篇发表在国际杂志Science上题为“Tlr7 drives sex differences in age- and Alzheimer’s disease–related demyelination”的研究报告中,来自美国威尔康乃尔医学院等机构的科学家们通过研究发现,抑制名为TLR7的免疫信号蛋白或能在阿尔兹海默病和普通衰老期间帮助保护机体大脑神经纤维周围的保护层。
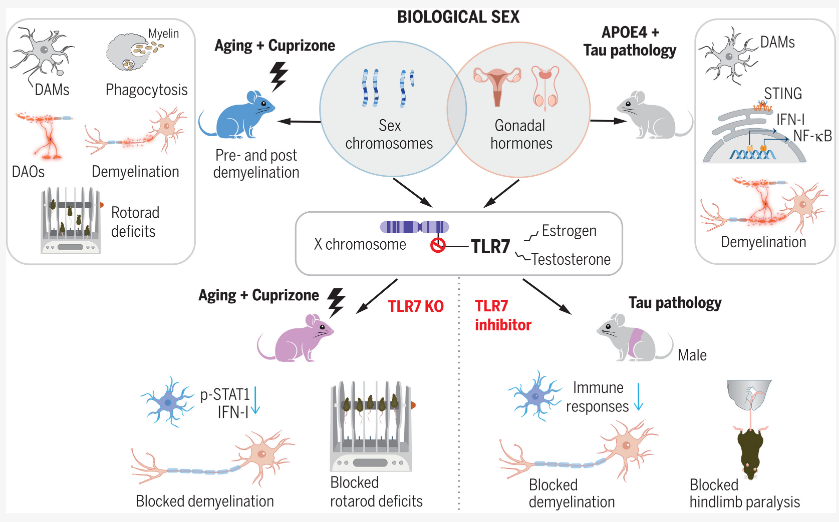
生物性别差异或能通过Tlr7来调节年龄或疾病病理学对脱髓鞘过程的反应
脊椎动物机体中的大多数神经纤维都包裹在主要由髓磷脂(myelin)构成的鞘中,髓磷脂是一种能保护纤维并大大提高信号传导效率的特殊蛋白质,脱髓鞘(demyelination)是一种髓鞘的破坏过程,其可能会发生在大脑炎症的背景下,通常会导致机体认知、运动和其它神经系统问题,这种现象常见于多发性硬化症(MS)、阿尔兹海默病、帕金森疾病和其它神经系统疾病以及普通的衰老过程中。
脱髓鞘相关的疾病通常会表现出一定的性别差异,这项研究中,研究人员寻找了或能解释这些差异的脱髓鞘背后的分子机制,通过对阿尔兹海默病小鼠模型进行实验后,他们发现,TLR7或能作为机体炎症脱髓鞘发生的驱动因素,尤其是在雄性小鼠中,但这也表明,移除或抑制这种免疫蛋白或能保护雄性和雌性小鼠抵御脱髓鞘的发生。研究者Li Gan博士说道,我们的研究结果具有潜在的临床意义,同时还强调了在研究诸如阿尔兹海默病等性别偏见的神经系统疾病时需要考虑性别差异的必要性。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


