中科院营养所章海兵团队揭示细胞程序性坏死及免疫稳态调控新机制
来源:生物世界 2022-01-27 17:55
细胞程序性坏死(Necroptosis)是一种由激酶RIPK1/RIPK3的级联磷酸化调控的促炎细胞死亡形式。细胞程序性坏死通过MLKL蛋白聚合在膜上打孔裂解细胞膜,执行细胞死亡并释放损伤相关分子模式(DAMPs)触发炎症反应。已知细胞程序性坏死参与调控系统性炎症反应综合征(SIRS)、系统性红斑狼疮及自身免疫性的淋巴增生综合征(AL
细胞程序性坏死(Necroptosis)是一种由激酶RIPK1/RIPK3的级联磷酸化调控的促炎细胞死亡形式。细胞程序性坏死通过MLKL蛋白聚合在膜上打孔裂解细胞膜,执行细胞死亡并释放损伤相关分子模式(DAMPs)触发炎症反应。已知细胞程序性坏死参与调控系统性炎症反应综合征(SIRS)、系统性红斑狼疮及自身免疫性的淋巴增生综合征(ALPS)等多种疾病。因此,对于细胞程序性坏死机制及其生物学意义的研究对于相关疾病的防治具有重要意义。
Caspase-8是天冬氨酸特异的半胱氨酸蛋白酶,最初被鉴定为细胞凋亡途径的起始蛋白。近几年的研究表明,caspase-8通过剪切RIPK1来抑制细胞程序性坏死。除此之外,caspase-8还参与细胞免疫稳态调控。临床上Caspase-8基因突变的病人会出现免疫缺陷疾病,并伴有免疫系统紊乱,表现为多器官的免疫细胞浸润并出现肉芽肿。研究发现Caspase-8通过其催化活性发挥功能,并且caspase-8的完全激活需要进行自我剪切。因此,探究caspase-8的自我剪切在调控免疫稳态中的作用机制,对于深入了解caspase-8的作用机制及相关临床疾病的治疗具有重要意义。
近日,中国科学院上海营养与健康研究所章海兵研究组在 Cell Death & Differentiation 期刊在线发表了题为:Caspase-8 auto-cleavage regulates programmed cell death and collaborates with RIPK3/MLKL to prevent lymphopenia 的研究成果。
该研究揭示了细胞凋亡起始蛋白caspase-8的自我剪切抑制细胞程序性坏死并协同坏死关键蛋白RIPK3/MLKL抑制淋巴细胞减少的免疫缺陷性疾病的发生。
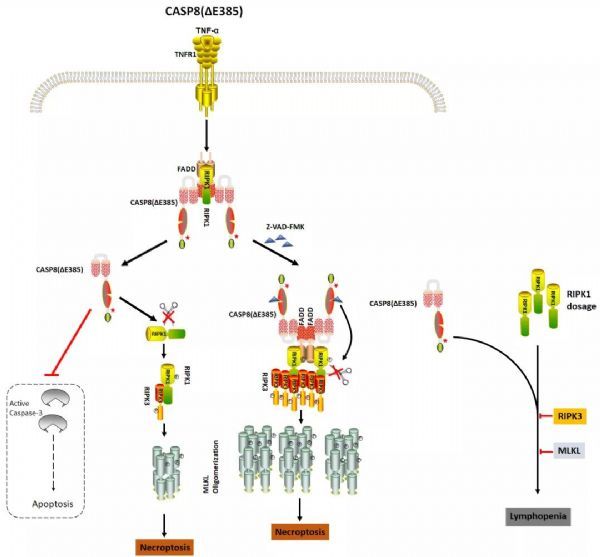
在该研究中,研究人员首先发现在细胞程序性坏死刺激条件下,caspase-8的自我剪切出现诱导性增强,因此推断caspase-8的自我剪切可能参与程序性坏死的调控。通过构建caspase-8自我剪切突变小鼠(Casp8ΔE385/ΔE385)发现,该小鼠可以抵抗细胞凋亡诱导的急性肝损伤,但高度敏感于程序性坏死诱导的全身炎症反应综合征(SIRS),该结果在动物水平证明caspase-8自我剪切可以促进细胞凋亡并抑制程序性坏死。
同时,研究人员进一步通过分离原代细胞实验证明caspase-8自我剪切负调控死亡复合体II的形成和稳定,从而抑制细胞程序性坏死的发生。此外,研究人员发现Casp8ΔE385/ΔE385小鼠患有轻微的脾脏肿大及CD8+T淋巴细胞减少性疾病(T cell lymphopenia)。在Casp8ΔE385/ΔE385小鼠中同时敲除坏死关键蛋白RIPK3/MLKL时,Casp8ΔE385/ΔE385Ripk3-/-和Casp8ΔE385/ΔE385Mlkl-/-小鼠出现更为严重的脾脏肿大及淋巴结肿大,其脾脏、淋巴结、外周血以及骨髓中的B细胞和T细胞及其各亚群均出现明显减少,鉴定为淋巴细胞减少的免疫缺陷性疾病(lymphopenia)。研究人员通过减少Casp8ΔE385/ΔE385Ripk3-/-和Casp8ΔE385/ΔE385Mlkl-/-小鼠中另一坏死调控蛋白RIPK1的表达剂量可以逆转上述表型,证明RIPK1在调控淋巴细胞减少疾病中的剂量调控效应。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。