《自然·癌症》:颠覆认知!科学家首次发现,杀伤性T细胞竟能启动先天性免疫程序,贴身杀伤MHC-I阴性癌细胞
来源:奇点糕 2023-08-17 15:59
未来,围绕NKG2D和NKG2DLs介导的抗肿瘤免疫机制,值得开展更深入的研究,或许能找到新型免疫治疗方案。
近日,杜克大学医学中心Peter E. Fecci团队在《自然·癌症》上发表的一项研究成果[1],再次刷新了我们对T细胞抗癌能力的认知。
这个研究意外地发现,原来CD8阳性T细胞可以杀死不表达MHC-I的癌细胞,这与之前的认知完全相反。更让人没想到的是,作为获得性免疫细胞,CD8阳性T细胞竟然是通过先天性免疫机制杀死不表达MHC-I的癌细胞。
Fecci团队的这一发现,不仅让我们对T细胞的抗癌能力有了新的认知,它还对肿瘤免疫学领域的一个共识提出了质疑,即肿瘤通过下调MHC-I实现免疫逃逸。在这个研究的基础上,我们或许能找到新的抗癌策略。

论文首页截图
抗原特异性T细胞杀伤癌细胞,是公认的适应性抗肿瘤细胞免疫模式。
在这个模式中,肿瘤细胞和抗原呈递细胞表面表达的MHC-I,是激活CD8阳性T细胞的关键,也是CD8阳性T细胞识别肿瘤细胞并发挥杀伤作用的核心。
有很多研究发现,肿瘤细胞表面MHC-I的减少或消失,会使肿瘤变成“冷肿瘤”,导致肿瘤实现免疫逃逸,甚至对免疫检查点抑制剂的治疗产生耐药性[2-6]。然而,近两年,有几个不太引人注意的研究发现,有时MHC-I的低表达反而与良好的预后有关[7,8]。
这种矛盾性的结果引起了Fecci团队的注意,他们想更好地评估肿瘤微环境中MHC-I表达的作用。
在这个研究中,他们对胶质瘤细胞系CT2A做了一番改造,让它表达一种弱免疫原性模式抗原TRP2,构建的癌细胞系称为CT2A-TRP2。在此基础上,他们又用CRISPR技术敲除了CT2A-TRP2中编码MHC-I重要组成部分β2m的基因,构建了不形成MHC-I的癌细胞系CT2A-TRP2-β2mKO。
随后,他们构建了表达能识别TRP2的TCR的CD8阳性T细胞(TRP2 T细胞),并开展了一个简单的体外实验,将TRP2 T细胞分别与CT2A-TRP2和CT2A-TRP2-β2mKO共培养。实验结果显示,表达MHC-I的CT2A-TRP2被T细胞杀死了,而不表达MHC-I的CT2A-TRP2-β2mKO则不受影响。
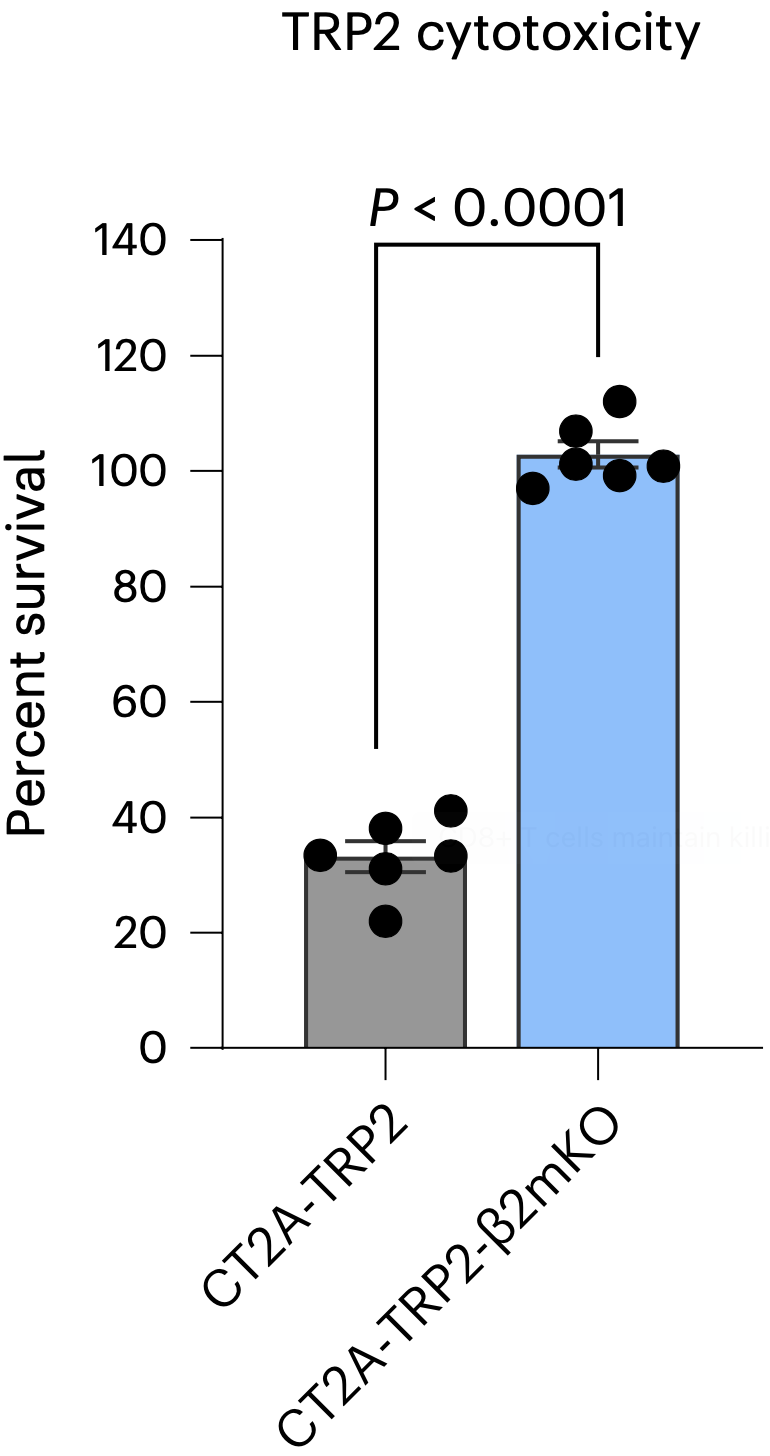
TRP2 T细胞的毒性
乍一看,这个结果不是证实了T细胞杀不了不表达MHC-I的癌细胞么!!
Fecci团队对体外的实验结果显然不放心,他们又在小鼠体内重复了一遍上述实验。
万万没想到的是,研究结果让他们大跌眼镜:如果在移植CT2A-TRP2-β2mKO后不给小鼠开展任何治疗的话,小鼠很快就会死亡;然而,如果给小鼠使用抗PD-1联合4-1BB激动剂治疗的话,小鼠长期存活率是100%,即使是4-1BB激动剂单药,小鼠的长期存活率也高达90%。
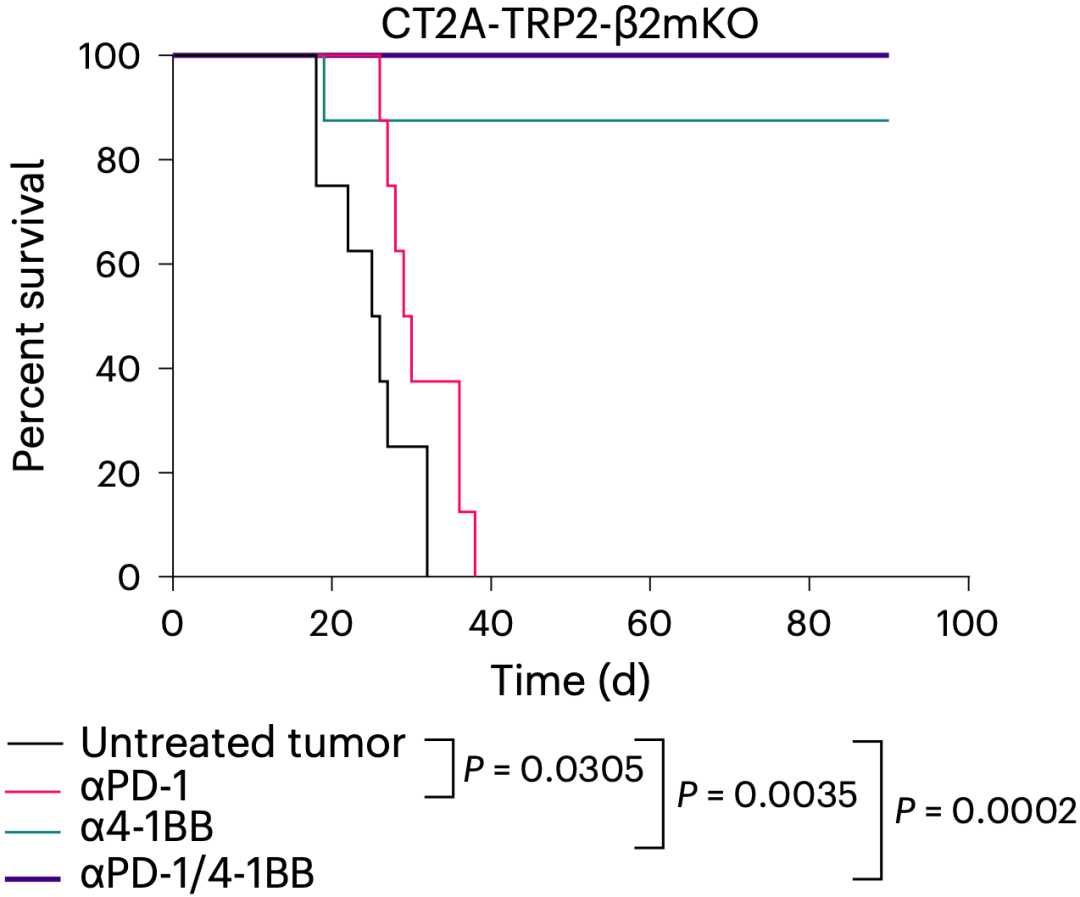
体内实验结果完全相反
这一相反的研究结果让Fecci团队意识到,肯定是体内的其他免疫细胞在其中发挥了作用。
他们首先想到的是不依赖于MHC的NK细胞,然而实验结果告诉他们,不是NK细胞的暗中帮助。只有特异性消除CD8阳性T细胞才会影响抗PD-1联合4-1BB激动剂的治疗效果。无论是在肿瘤植入前,还是植入后的任何时间点,只要清除CD8阳性T细胞,免疫治疗就无效了。
如此看来,不表达MHC-I的癌细胞仍是被CD8阳性T细胞杀死的。重要的是,Fecci团队还注意到,真正的杀手是被激活的抗原特异性CD8阳性T细胞。后续的研究表明,巨噬细胞等抗原呈递细胞在其中起到了重要的作用。
至于抗原特异性CD8阳性T细胞找到并杀死不表达MHC-I癌细胞的方式,Fecci团队也做了很细致的研究。结果表明,在抗原特异性CD8阳性T细胞被(巨噬细胞和表达MHC-I的癌细胞等)激活之后,它可以以一种不依赖于抗原和MHC-I,但依赖于与癌细胞接触的方式,无差异杀死不表达MHC-I的癌细胞。
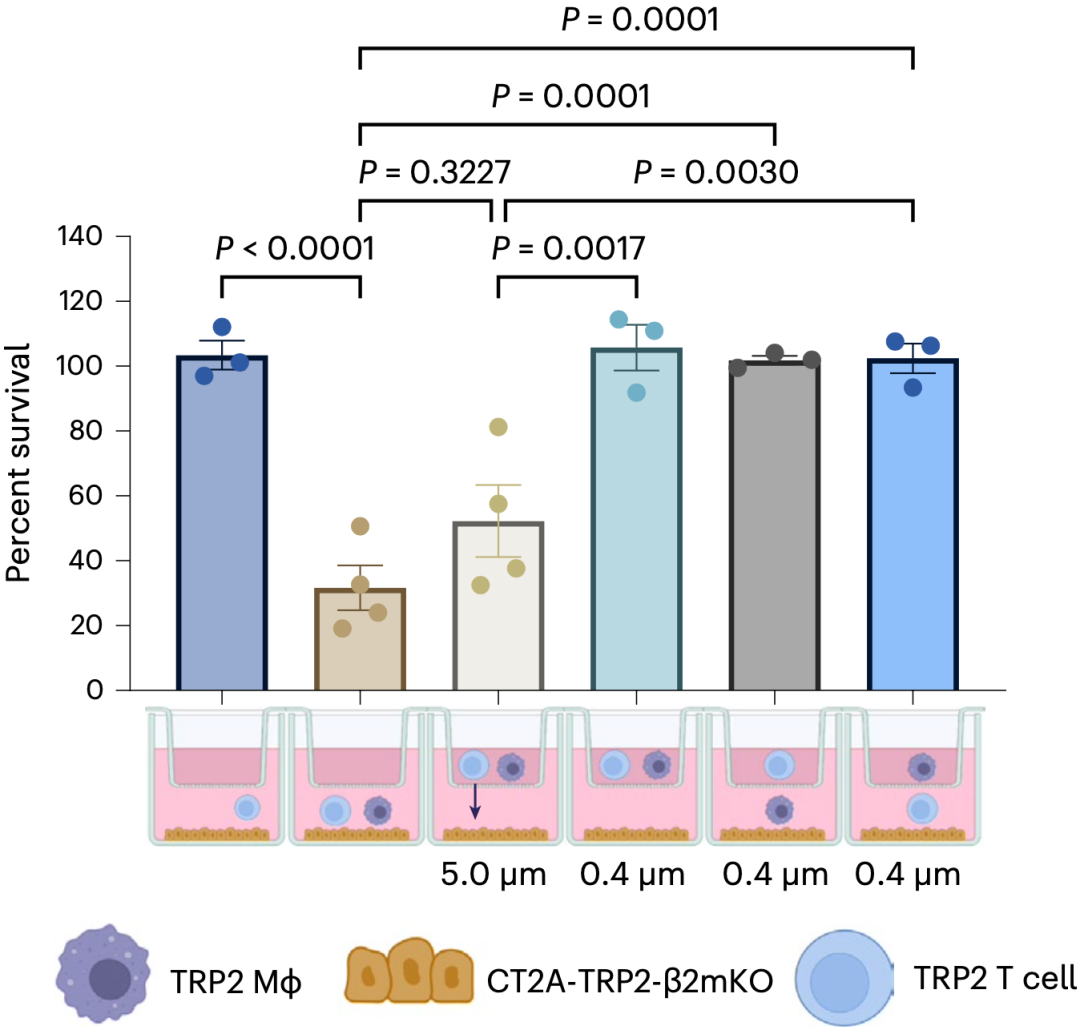
CD8阳性T细胞被激活且能与癌细胞接触的情况下,才能杀死没有MHC-I的癌细胞
从具体机制上来看,不表达MHC-I的癌细胞上NKG2D的配体(NKG2DLs)高表达,刚好可以被处于激活状态的抗原特异性CD8阳性T细胞表面的NKG2D识别,激活下游的颗粒酶和穿孔素等杀伤分子,进而使抗原特异性CD8阳性T细胞具备无差异的杀伤能力。由于正常组织细胞NKG2DL表达水平较低,避免了T细胞的杀伤。
Fecci团队认为,T细胞的这种抗癌能力,是一种我们之前没有认知到的,由获得性免疫反应启动的,先天性免疫反应。
总的来说,Fecci团队的这项研究成果让我们对T细胞的抗癌能力有了新的认知。也让我们意识到,肿瘤细胞即使下调MHC-I也不能完全躲避CD8阳性T细胞的杀伤。
未来,围绕NKG2D和NKG2DLs介导的抗肿瘤免疫机制,值得开展更深入的研究,或许能找到新型免疫治疗方案。
参考文献:
[1].Lerner EC, Woroniecka KI, D'Anniballe VM, et al. CD8+ T cells maintain killing of MHC-I-negative tumor cells through the NKG2D-NKG2DL axis. Nat Cancer. 2023. doi:10.1038/s43018-023-00600-4
[2].Zaretsky JM, Garcia-Diaz A, Shin DS, et al. Mutations Associated with Acquired Resistance to PD-1 Blockade in Melanoma. N Engl J Med. 2016;375(9):819-829. doi:10.1056/NEJMoa1604958
[3].Castro M, Sipos B, Pieper N, et al. Major histocompatibility complex class 1 (MHC1) loss among patients with glioblastoma (GBM)[J]. 2020.
[4].Chow RD, Guzman CD, Wang G, et al. AAV-mediated direct in vivo CRISPR screen identifies functional suppressors in glioblastoma. Nat Neurosci. 2017;20(10):1329-1341. doi:10.1038/nn.4620
[5].Gettinger S, Choi J, Hastings K, et al. Impaired HLA Class I Antigen Processing and Presentation as a Mechanism of Acquired Resistance to Immune Checkpoint Inhibitors in Lung Cancer. Cancer Discov. 2017;7(12):1420-1435. doi:10.1158/2159-8290.CD-17-0593
[6].Torrejon DY, Abril-Rodriguez G, Champhekar AS, et al. Overcoming Genetically Based Resistance Mechanisms to PD-1 Blockade. Cancer Discov. 2020;10(8):1140-1157. doi:10.1158/2159-8290.CD-19-1409
[7].Busch E, Ahadova A, Kosmalla K, et al. Beta-2-microglobulin Mutations Are Linked to a Distinct Metastatic Pattern and a Favorable Outcome in Microsatellite-Unstable Stage IV Gastrointestinal Cancers. Front Oncol. 2021. doi:10.3389/fonc.2021.669774
[8].Tang F, Zhao YH, Zhang Q, et al. Impact of beta-2 microglobulin expression on the survival of glioma patients via modulating the tumor immune microenvironment. CNS Neurosci Ther. 2021;27(8):951-962. doi:10.1111/cns.13649
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


