IRE1α激酶抑制剂KIRA6可以钝化由免疫原性细胞死亡引起的应激性炎症
来源:本站原创 2021-08-30 17:21
越来越多的证据表明,通过刺激应激或死亡的癌细胞释放免疫调节/促炎因子,内质网应激后的未折叠蛋白反应(UPR)的免疫原性治疗有利于癌细胞-免疫相互作用。
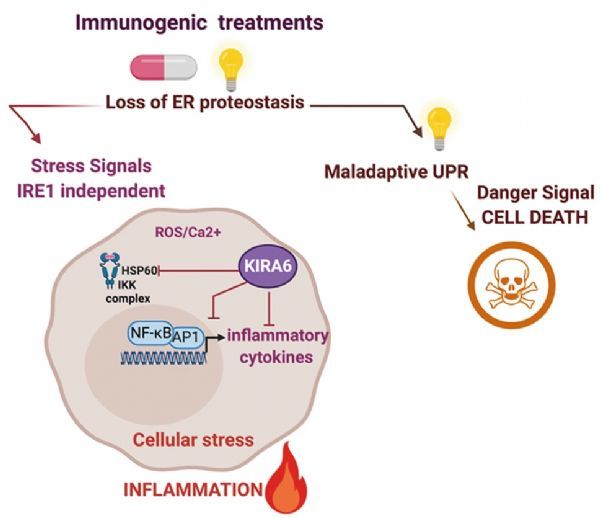
越来越多的证据表明,通过刺激应激或死亡的癌细胞释放免疫调节/促炎因子,内质网应激后的未折叠蛋白反应(UPR)的免疫原性治疗有利于癌细胞-免疫相互作用。UPR驱动的促炎细胞因子/趋化因子的转录对肿瘤生长和抗肿瘤免疫产生有利或有害的影响,但在免疫原性治疗中控制癌细胞炎症输出的细胞自主机制仍不清楚。在这里,作者分析了对免疫原性或弱免疫原性治疗反应的癌细胞的转录组。生物信息学驱动的通路分析表明,免疫原性处理激活了NF-κB/ ap-1炎症应激反应,该反应与细胞死亡和UPR分离。总之,该研究揭示了HSP60是由免疫原性处理引起的NF-κB/ ap-1炎症应激反应的上游调控因子,kira6可抑制HSP60。
图片来源:https://www.nature.com/articles/s41418-021-00853-5
在抗癌治疗中,应激或死亡的癌细胞与肿瘤微环境进行复杂的对话,最终刺激或抑制炎症和免疫反应。抗癌疗法的子集(包括蒽环类和光动力疗法)刺激癌细胞自主通路,导致一种免疫刺激性凋亡,称为免疫原性细胞死亡(ICD)。ICD的一个特点是伴随着活性氧(ROS)和内质网(ER)应激的刺激,它们共同唤起表面暴露或损伤相关分子模式(DAMPs)的释放。DAMPs作为危险信号,通过与树突状细胞表面的特定病原体识别受体(PRRs)结合,被树突状细胞(DCs)感知并解码,最终触发抗原特异性抗肿瘤免疫。
ICD的机制基础和体内研究揭示了内质网稳态的扰乱触发了未折叠蛋白反应(UPR)的PERK/eIF2α-P轴,协调了危险信号。相比之下,IRE1α在ICD中的作用仍然不被充分了解。
然而,尽管危险信号的关键作用已经在临床前和一些临床环境中得到了验证,但关于控制免疫原性治疗诱导的普遍免疫反应促炎输出的分子途径的信息却少得多。此外,转录炎症特征是否描绘了免疫原性治疗的一个显著特征仍未探索。
KIRA6抑制免疫原性治疗的炎症特征
图片来源:https://www.nature.com/articles/s41418-021-00853-5
越来越多的证据表明,由免疫原性治疗引起的内质网稳态扰动引起的炎症可能与危险信号起着截然不同的作用。在免疫原性化疗的反应中,由应激的癌细胞释放的CCL2通过激活抗原提呈细胞来增强免疫原性反应的初始阶段。然而,CCL2也会引发继发性炎症,最终导致血管生成、转移和复发。通过将癌细胞暴露于ICD产生的癌症疫苗有利于在接种部位招募中性粒细胞,通过释放一组趋化因子来塑造细胞对病原体的反应。然而,在肿瘤背景下,促使中性粒细胞浸润到肿瘤的趋化因子可能通过保护癌细胞免受细胞毒性T细胞的侵袭而有利于肿瘤免疫逃逸。因此,应激的癌细胞引起的无菌炎症反应可能对肿瘤微环境和免疫原性治疗的总体输出产生环境依赖效应。
综上所述,该研究发现两种已建立的ICD范式具有共同的转录特征,包括与普遍免疫反应平行的促炎早期应激反应,这有助于MTX的体内免疫原性。这种早期促炎反应涉及HSP60,可被KIRA6否决,独立于IRE1α。考虑到IRE1α通路的小分子抑制剂已被提出作为潜在的抗癌疗法,作者的研究也对使用KIRA6评估IRE1α在炎症病理中的作用提出了谨慎。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。