Nature:胡政/贺雄雷/何真团队揭示早期肿瘤从多克隆至单克隆转变的演化新模式
来源:生物世界 2024-11-04 09:19
中国科学院深圳先进技术研究院合成生物学研究所首次揭示了肿瘤从多克隆向单克隆转变的早期演化新模式,并解析了肿瘤多克隆起源的细胞间通讯与互作机制。这一发现不仅为肿瘤的早期发生机制提供了新的科学视角。
中国科学院深圳先进技术研究院合成生物学研究所胡政、中山大学贺雄雷和何真团队合作,在 Nature 期刊发表了题为Polyclonal-to-monoclonal transition in colorectal precancerous evolution 的研究论文。
该研究首次揭示了肿瘤从多克隆向单克隆转变的早期演化新模式,并解析了肿瘤多克隆起源的细胞间通讯与互作机制。这一发现不仅为肿瘤的早期发生机制提供了新的科学视角,同时也为癌症的精准早期筛查和干预提出了新的思路。

研究团队首次在哺乳动物中建立了基于碱基编辑器的细胞谱系示踪技术(称为SMALT),实现了小鼠体内单细胞分辨率的高精度谱系追踪。SMALT技术结合了胞苷脱氨酶(AID)、人工DNA条形码序列和Tet-On可诱导表达系统,通过AID介导的靶向突变和后续DNA测序,能够大规模、高精确地重建单细胞谱系树(下图a)。
研究团队利用携带SMALT系统的转基因小鼠,构建了两种经典的小鼠肠癌模型:炎症诱导肠癌模型(AOM/DSS模型)和多发性息肉模型(ApcMin/+模型)。在谱系树分析中,团队发现大多数(66.7%)炎症诱导的肠癌和所有Apc肠息肉均表现出多克隆起源(下图b)。通过整合DNA条形码突变、全基因组测序和单细胞转录组数据,研究团队进一步发现单克隆肿瘤(下图c)比多克隆肿瘤具有更高的恶性程度,这表明单克隆肿瘤可能代表肿瘤进展的更“晚期”阶段。基于这些发现,团队提出了肿瘤发生的“多克隆向单克隆转变”新模型(下图d),为早期肿瘤演化提供了新的理论框架。
研究团队同时收集了107例人类散发性肠息肉及伴发结直肠癌的患者队列。基因组测序数据显示,大约30%的人类肠息肉是多克隆起源,且具有较低的突变负荷和拷贝数变异。病理特征也表明,相比单克隆息肉,多克隆息肉尺寸更小、恶性程度更低;相反,单克隆息肉表现出更多的基因组变异、较大尺寸和更高的恶性程度。这些发现在人体中验证了小鼠的谱系示踪结果,共同支持了多克隆向单克隆转变的早期肿瘤演化模式。
基于上述结果,研究团队提出了早期肿瘤发生过程中多克隆-单克隆转换的新模式(下图d),强调了这一过程中特定基因组和微环境变化以及细胞间相互作用的重要性。这些发现为理解肿瘤起源提供了全新的概念框架,并提出通过靶向细胞间通讯来实现早期干预的肿瘤预防新策略。因此,该研究开辟了一个新的研究领域,即探索早期肿瘤发生中的多克隆形成机制和细胞间相互作用,为肿瘤早筛、风险预测和早期靶向干预提供了全新的思路。
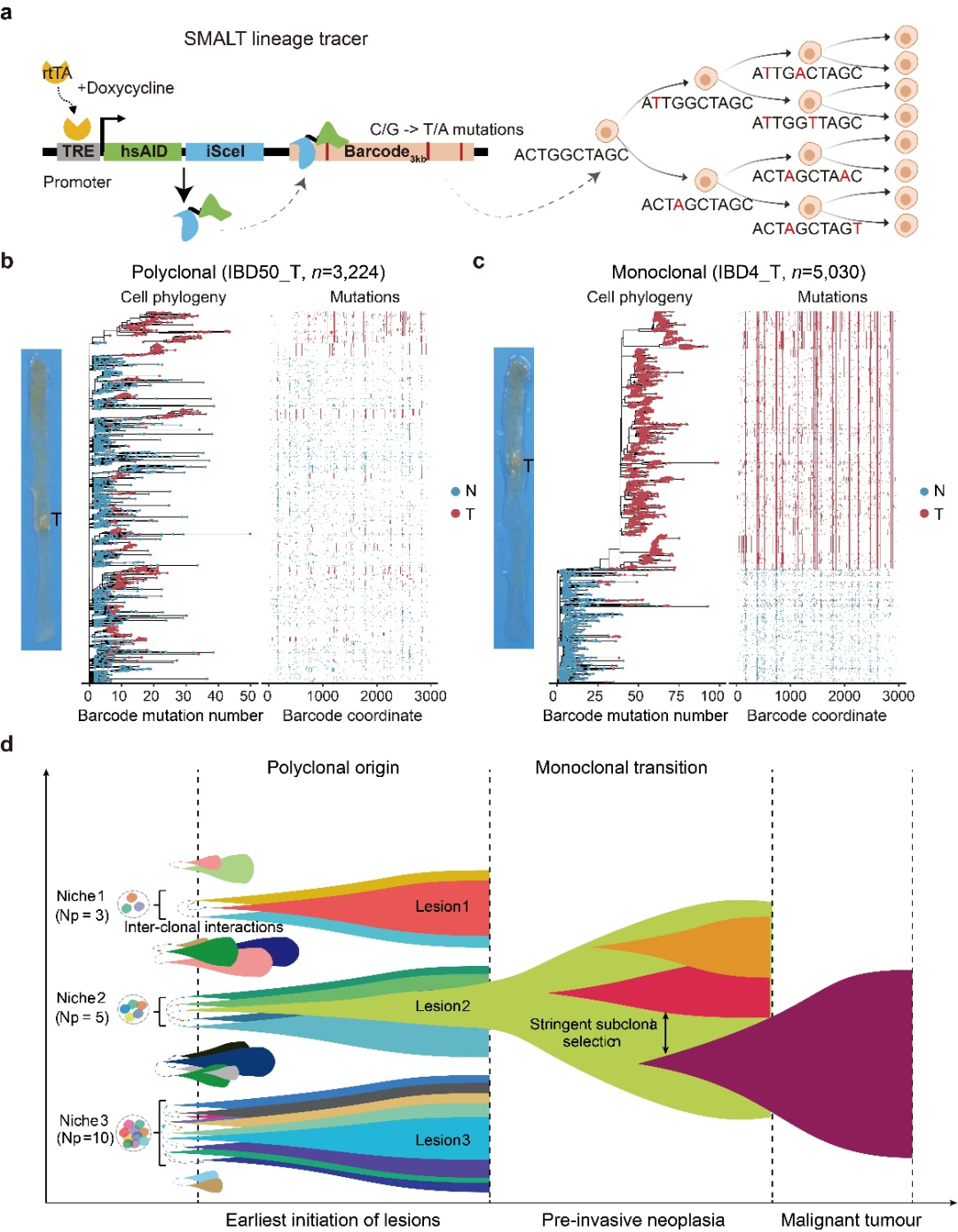
单细胞谱系示踪早期肿瘤从多克隆至单克隆转变的演化新模式

孔雀羽毛颜色从多彩逐渐向单一转变,表达了肿瘤细胞从多克隆状态逐渐向单克隆状态演化的过程
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


