新冠病毒刺突蛋白在大脑中的长期潜伏!Cell Host Microbe揭示长新冠的神经症状之谜
来源:生物谷原创 2024-12-10 11:24
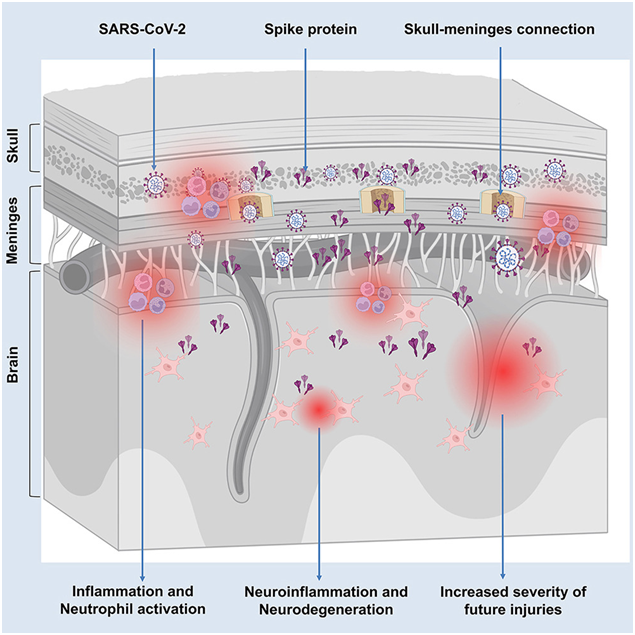
这项新研究表明,头骨骨髓和脑膜中的刺突蛋白浓度明显升高,甚至在感染数年后也是如此。
你是否曾想过,新冠病毒(Severe Acute Respiratory Syndrome Coronavirus 2, SARS-CoV-2)可能在感染后多年内悄悄地影响我们的大脑?来自德国慕尼黑亥姆霍兹中心和慕尼黑大学的研究人员最近发现了一种机制,可能解释了长新冠(long COVID)患者的神经症状。他们指出,新冠病毒的刺突蛋白在感染后可以在大脑保护层、脑膜以及头骨骨髓中存留长达四年之久。这种刺突蛋白的持续存在可能会引发慢性炎症,并增加患神经退行性疾病的风险。
相关研究结果于2024年11月29日在线发表在Cell Host & Microbe期刊上,论文标题为“Persistence of spike protein at the skull-meninges-brain axis may contribute to the neurological sequelae of COVID-19”。

这项研究由慕尼黑亥姆霍兹中心智能生物技术研究所主任Ali Ertürk教授领导。Ertürk教授和他的团队还发现,mRNA COVID-19疫苗能显著减少SARS-CoV-2刺突蛋白在大脑中的积累。然而,在感染后,刺突蛋白在头骨和脑膜中的持续存在为新的治疗策略提供了靶标。
刺突蛋白在大脑中积累
Ertürk教授团队开发了一种新型的人工智能成像技术,它能够使器官和组织样本变得透明,从而实现细胞结构、代谢物以及病毒蛋白的三维可视化观察。利用这项技术,他们在来自COVID-19患者和小鼠的组织样本中发现了以前难以检测到的刺突蛋白分布。这项新研究表明,头骨骨髓和脑膜中的刺突蛋白浓度明显升高,甚至在感染数年后也是如此。刺突蛋白与所谓的ACE2受体结合,而ACE2受体在这些区域特别丰富。论文第一作者Zhouyi Rong博士解释说:“这可能会使这些组织特别容易受到刺突蛋白长期积累的影响。”
Ertürk补充说:“我们的数据还表明,大脑边界持续存在的刺突蛋白可能会导致COVID-19和长新冠对神经系统的长期影响。这包括加快的大脑衰老,可能导致受影响的人丧失五到十年的健康大脑功能。”
疫苗可减少刺突蛋白积累和大脑炎症
Ertürk团队发现BioNTech/Pfizer公司的mRNA COVID-19疫苗能显著减少大脑中刺突蛋白的积累。不过,他们没有研究其他mRNA疫苗或其他类型的疫苗,如基于载体或蛋白的疫苗。与未接种疫苗的小鼠相比,接种了mRNA COVID-19疫苗的小鼠在大脑组织和头骨骨髓中的刺突蛋白水平较低。不过,降低的幅度仅为50%左右,残留的刺突蛋白仍对大脑构成毒性风险。
Ertürk教授说:“这种减少是重要的一步。我们的研究结果虽然来自于小鼠模型,只能部分应用于人类,但这表明需要更多的疗法和干预措施来全面解决SARS-CoV-2感染造成的长期负担。”此外,还需要进行更多的研究,以评估这些发现对长新冠患者的意义。
长新冠:社会和医疗挑战
在全球范围内,50%至60%的人口感染了SARS-CoV-2,其中5%至10%的人出现了长新冠症状。总计约有4亿人可能携带大量刺突蛋白。Ertürk教授说:“这不仅是一个个人健康问题,也是一个社会挑战。我们的研究表明,mRNA COVID-19疫苗能显著降低长期神经系统后果的风险,并提供重要的保护。然而,接种疫苗后仍可能发生感染,导致体内持续存在刺突蛋白。这可能会导致慢性大脑炎症,增加中风和其他脑损伤的风险,从而对全球公共卫生和世界各地的医疗保健系统产生重大影响。”
诊断和治疗方面的进步
Ertürk说:“我们的发现为诊断和治疗COVID-19对神经系统的长期影响提供了新的可能性。”与大脑组织不同,头骨骨髓和脑膜——容易积聚刺突蛋白的区域——更容易进行医学检查。结合用于检测组织样本中特定蛋白的测试,这可能能够识别血浆或脑脊液中的刺突蛋白或炎症标志物。Ertürk解释说:“这些标志物对于早期诊断COVID-19相关神经系统并发症至关重要。此外,确定这些蛋白的特征可能有助于开发靶向疗法和生物标志物,以更好地治疗甚至预防COVID-19引起的神经系统损伤。”
慕尼黑亥姆霍兹中心的Ulrike Protzer教授在强调这项研究的广泛影响时补充说:“鉴于COVID-19目前在全球的影响以及对长期影响的日益关注,这项研究揭示了大脑入侵途径和意想不到的长期宿主参与,这是非常及时的。这些重要的见解不仅具有重要的科学意义,而且对社会也具有重大意义。”(生物谷Bioon.com)
参考资料:
Zhouyi Rong et al. Persistence of spike protein at the skull-meninges-brain axis may contribute to the neurological sequelae of COVID-19. Cell Host & Microbe, 2024, doi:10.1016/j.chom.2024.11.007.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


