浙大校友发表Nature论文:从头设计蛋白质,实现蛋白靶向降解,创立AI制药公司,种子轮即获10亿美元融资
来源:生物世界 2024-10-08 13:37
这项工作代表了靶向蛋白质降解领域的一大重要进展,开发出了一种多功能、可基因编码的蛋白质降解技术,为多种难治性疾病的精准治疗提供了新的可能性。
靶向蛋白质降解是治疗有害蛋白质引起的疾病的一种很有前景的策略,例如PROTAC(蛋白靶向降解嵌合体)以及LYTAC(溶酶体靶向降解嵌合体),前者通过泛素-蛋白酶体系统诱导靶蛋白的泛素化以实现靶蛋白降解,后者依赖于溶酶体靶向受体(LTR)的识别,主动将靶蛋白转运到溶酶体内进行降解。
然而,当前的蛋靶向蛋白质降解技术都有期局限性,它们通常需要复杂的化学修饰,这使得生产制造具有挑战性,并将它们的靶标适用性限制在了一个较窄的内。
2024年9月25日,蛋白质设计先驱 David Baker 教授团队(黄步威博士为第一作者)与2022年诺贝尔化学奖得主Carolyn Bertozzi教授团队合作,在国际顶尖学术期刊 Nature 上发表了题为:Designed endocytosis-inducing proteins degrade targets and amplify signals 的研究论文。
该研究团队从头设计了一类新型蛋白质——EndoTag(endocytosis-triggering binding protein),在此基础上构建了基于人工设计蛋白的溶酶体靶向降解嵌合体——pLYTAC,能够在活细胞中靶向降解大量疾病相关分子靶点,该技术具有巨大的治疗潜力,包括应用于癌症精准治疗以及自身免疫疾病和神经退行性疾病的治疗。


David Baker教授(左),黄步威博士(右)
黄步威博士为该论文的第一作者,其本科就读于浙江大学药学院,硕士毕业于约翰·霍普金斯大学,之后在华盛顿大学 David Baker 实验室读博。目前为Xaira Therapeutics联合创始人,Xaira 由 David Baker、Carolyn Bertozzi 等人联合创立,斯坦福大学前校长、基因泰克公司前首席科学家 Marc Tessier-Lavigne 任CEO,该公司于今年4月份宣布完成10亿美元种子轮融资。该公司致力于通过新兴AI技术的端到端应用,帮助我们重新设计药物的发现和开发之旅。
LYTAC(溶酶体靶向降解嵌合体)技术由诺贝尔化学奖得主 Carolyn Bertozzi 教授团队于2020年开发的一种靶向蛋白质降解技术。而现在,通过与 David Baker 教授团队合作,他们设计了一种新型蛋白质,使用更简单的成分,实现更高的精度,并且可以用于靶向降解细胞表面的任何目标蛋白质。
内源性配体能够触发细胞表面受体的内吞作用和溶酶体转运,在此基础上,诺贝尔化学奖得主 Carolyn Bertozzi 教授团队于2020年开发的一种靶向蛋白质降解新技术——LYTAC(溶酶体靶向降解嵌合体),将经过修饰的天然配体与靶向结合蛋白融合来靶向特定蛋白质进行降解。尽管该方法很有效,但也可能会受到与天然配体竞争以及对化学修饰的要求的限制,这限制了基因可编码性,并使制造过程复杂化。而且,还可能不存在能够通过特定受体促进内吞作用的天然配体。
在这项最新研究中,David Baker 教授团队联合 Carolyn Bertozzi 教授团队,利用他们之前开发的蛋白质从头设计工具Rosetta,设计了一种新型蛋白质——EndoTag(endocytosis-triggering binding protein),克服了上述靶向蛋白质降解技术的挑战,使用更简单的成分,实现更高的精度,并且可以用于靶向降解细胞表面的任何目标蛋白质。
该研究设计了靶向四种受体系统胰岛素样生长因子2受体(IGF2R)和唾液酸糖蛋白受体(ASGPR)、分拣受体(sortilin)和转铁蛋白受体(TfR)的人工配体——EndoTag,将其与LYTAC(溶酶体靶向降解嵌合体)技术结合,进而构建了基于人工设计蛋白的LYTAC——pLYTAC,实现对靶蛋白的溶酶体运输和靶向降解。由于这些受体蛋白具有不同的组织分布,因此,不同的EndoTag可以实现对不同组织的靶向降解。EndoTag的基因可编码性,使其可通过治疗性mRNA或基因疗法递送。由于其被被设计为在不干扰天然配体的情况下与特定受体结合,因此可能最大限度地减少脱靶效应。
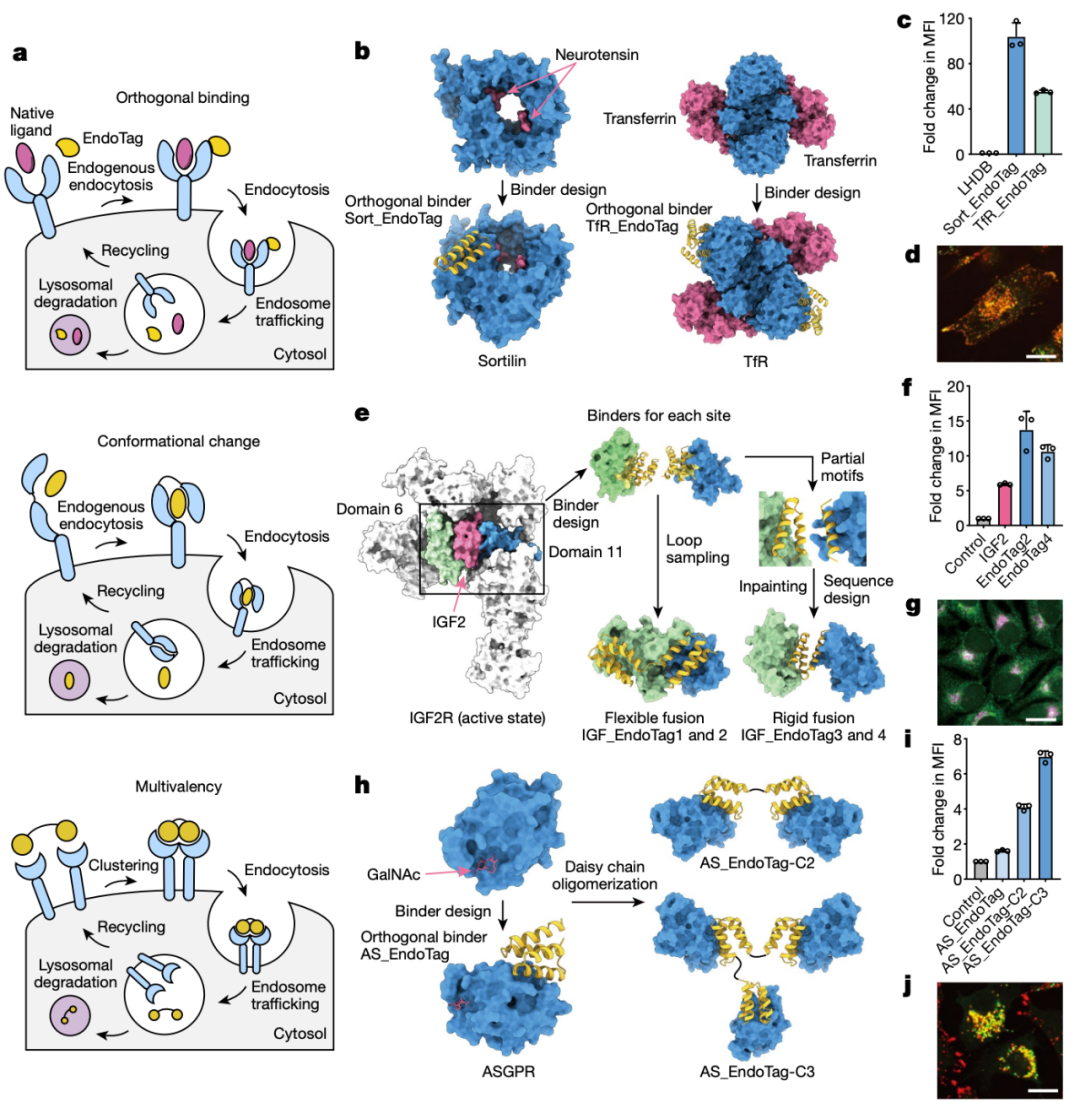
计算设计蛋白质系统的一大优势是可以在分子层面实现精准治疗。研究团队通过将多个EndoTag与他们之前设计的蛋白质开关LOCKR技术结合,创建了逻辑门控pLYTAC,实现更高特异性的蛋白质靶向降解。
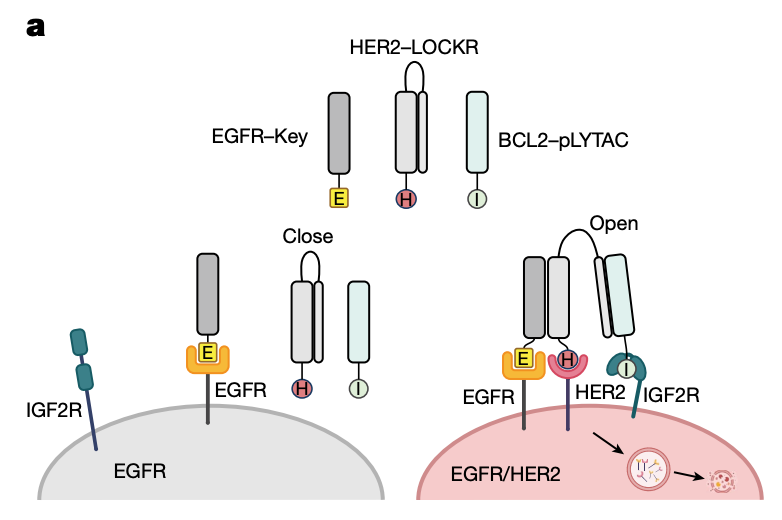
研究团队进一步对两种重要的致病蛋白EGFR和PD-L1进行了验证,EGFR在许多癌症中过表达,利用EndoTag与EGFR结合域的结合,pLYTAC有效降解了EGFR,与现有方法相比,EGFR水平下降更显著。同样,pLYTAC靶向降解了PD-L1,进而增强了肿瘤免疫应答。
总的来说,通过促进内吞作用,EndoTag融合通过经过工程改造的配体-受体系统将信号转导增加近100倍。作为靶向降解诱导剂、内吞依赖性通路的信号激活剂,以及靶向抗体-药物偶联物(ADC)和抗体-RNA偶联物(ARC)的细胞摄取诱导剂,EndoTag具有相当大的治疗潜力。
最后,研究团队表示,这项工作代表了靶向蛋白质降解领域的一大重要进展,开发出了一种多功能、可基因编码的蛋白质降解技术,为多种难治性疾病的精准治疗提供了新的可能性。研究团队的目标是继续扩大EndoTag适用的疾病范围,从而可能为更多疾病提供治疗方案。研究团队还计划探索pLYTAC的临床应用,希望能够开发出治疗癌症、自身免疫疾病和神经系统疾病的新疗法。此外,EndoTag还有助于科学家们更好地理解细胞生物学,为深入了解疾病复杂机制提供新见解。这项研究也强调了现代蛋白质设计的变革潜力——不仅仅是发现生物功能,还能创造新的生物功能。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


