Nature丨白介素-23维持肠道稳态的机理
来源:生物探索 2024-08-13 10:48
这篇文章通过深入分析ILC3细胞和IL-23在肠道免疫中的复杂互动,揭示了潜在的治疗靶点,并为理解慢性炎症性疾病的机制提供了新的视角。
白介素-23(Interleukin-23 IL-23)是慢性炎症性疾病中的一个主要介导因子和治疗靶点,同时在肠道稳态或急性感染后也能提供组织保护。然而,决定这些有益与病理性结果的机制仍然不清楚。IL-23是一种属于IL-12家族的异二聚体细胞因子,包含一个共享的IL-12p40亚基和一个特定的IL-23p19亚基。小鼠模型、患者的遗传研究和临床试验均表明,IL-23是自身免疫和慢性炎症性疾病(包括炎症性肠病、银屑病、类风湿性关节炎和多发性硬化症)中的一个主要介导因子。
全基因组关联研究发现,IL-23受体(IL-23R)基因位点的单核苷酸多态性与疾病发生密切相关,并且阻断IL-23在部分患者中提供了治疗益处。然而,IL-23还表现出众多有益的抗微生物和组织保护功能。这在肠道中尤为明显,IL-23在响应微生物群落定殖时产生,阻断IL-23会改变微生物群的组成,增加对肠道感染的易感性,或在某些情况下加剧肠道炎症。此外,具有IL23R功能缺失突变的人在粘膜表面更易受到各种细菌和真菌感染。这表明IL-23在肠道中既能介导组织保护又能引发病理反应,但控制这些截然不同结果的细胞和分子机制仍然不清楚。
近日,来自康奈尔大学的Gregory F. Sonnenberg 团队在 Nature 上发表题为CTLA-4-expressing ILC3s restrain interleukin-23-mediated inflammation 的文章。研究揭示了ILC3内在的CTLA-4作为一个关键检查点,限制了IL-23的病理性结果,表明在炎症性肠病中这些淋巴细胞的破坏可能导致慢性炎症。

作者首先通过单细胞转录组方法,分析了小肠中所有表达IL-23受体的细胞,并评估了它们对IL-23的急性反应,发现ILC3细胞中CTLA-4显著上调。流式细胞实验进一步验证了这一发现,确认CTLA-4主要在NKp46+ ILC3细胞中表达,并且这种表达受肠道微生物和IL-23信号通路调控。
此外,研究使用NKp46-cre Ctla4-f/f小鼠模型,通过特异性敲除ILC3中的CTLA-4,观察到这些小鼠表现出更严重的肠道炎症和免疫失衡,证明CTLA-4在ILC3中的关键调节作用。体外共培养实验表明,IL-23或CTLA-4的存在能够减少髓系细胞上的共刺激分子(CD80和CD86),增加PD-L1的生物可利用性。在人样本分析中,研究发现IL-23可以上调来自扁桃体的人ILC3中的CTLA-4表达,且在炎症性肠病患者的肠道组织中,CTLA-4+ ILC3的比例增加,这表明CTLA-4+ ILC3在调节IL-23介导的炎症和保护肠道免疫平衡方面具有重要作用。
这项研究提供了一个关于IL-23在肠道稳态和组织保护中的新模型,并且指出了ILC3特异性的CTLA-4如何平衡IL-23的促炎作用,以维持肠道的免疫平衡。这为未来的治疗策略提供了新的思路,特别是在涉及IL-23和CTLA-4的炎症性疾病中。这篇文章通过深入分析ILC3细胞和IL-23在肠道免疫中的复杂互动,揭示了潜在的治疗靶点,并为理解慢性炎症性疾病的机制提供了新的视角。
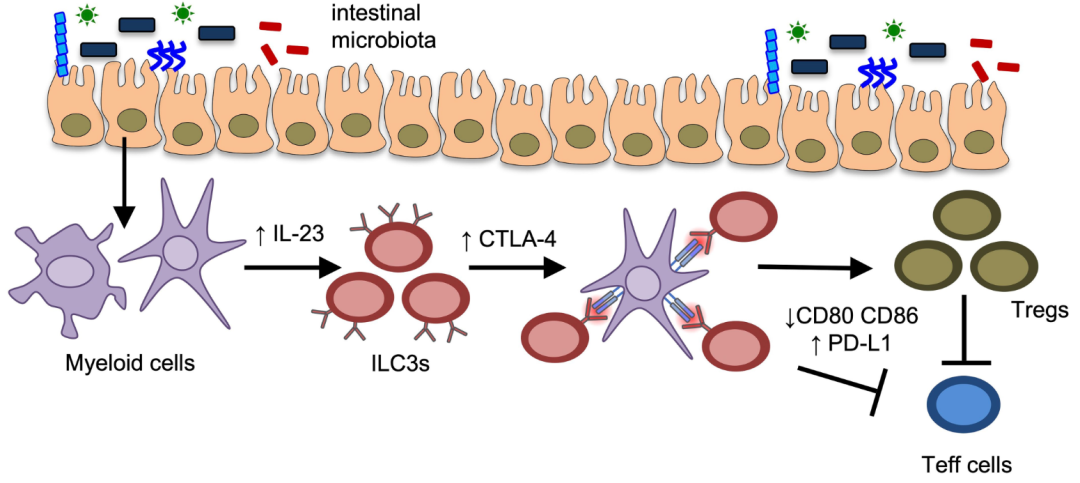
模式图(Credit: Nature)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


