项鹏/邓春华团队开发先导编辑+干细胞疗法,有望治疗男性不育
来源:生物世界 2023-09-19 14:16
基于先导编辑的体外SLC编辑是一种有前景的遗传性原发性性腺功能减退症(HPH)治疗策略,并有望用于治疗多种生殖系统的遗传性疾病。
中山大学中山医学院项鹏团队联合中山大学附属第一医院邓春华团队,在 Advanced Science 期刊发表了题为:Precise Correction of Lhcgr Mutation in Stem Leydig Cells by Prime Editing Rescues Hereditary Primary Hypogonadism in Mice 的研究论文。
该研究首次通过先导编辑(PE)在体外修正了小鼠的睾丸间质干细胞(SLC)致病基因突变,将基因修正后的SLC移植到遗传性原发性性腺功能减退症(HPH)小鼠后可有效再生睾丸间质细胞(LC),进而恢复睾酮生成,重启性发育,挽救精子发生,并产生可育后代。
这些结果表明,基于先导编辑的体外SLC编辑是一种有前景的遗传性原发性性腺功能减退症(HPH)治疗策略,并有望用于治疗多种生殖系统的遗传性疾病。

睾丸间质干细胞(Stem LeydigCell,SLC)能够通过增殖和分化再生新的睾丸间质细胞,在维持成年睾丸间质细胞稳态中发挥重要作用。项鹏/邓春华团队此前的研究发现,自体SLC移植可以提高非人灵长类动物模型的睾酮水平,改善精子发生,并改善原发性性腺功能减退症(PH)的相关症状。
最近的几项研究鉴定出具有克隆性、自我更新能力和多谱系分化潜能的人类SLC。更重要的是,人类SLC可在体外和体内分化为产生睾酮的功能性间质细胞。
这些研究结果表明,SLC移植是治疗男性原发性性腺功能减退症(PH)的有希望的治疗方法。然而,由于遗传性原发性性腺功能减退症(HPH)患者SLC存在遗传基因缺陷,因此,SLC移植无法实现治疗。
近年来,基因组编辑技术的出现,使研究人员能够操作多种细胞类型的DNA序列,从而用于治愈遗传性疾病。在体外对造血干细胞进行基因编辑以治疗镰状细胞病和地中海贫血已进入临床试验阶段,并成功治愈了多位患者。
因此,如果在睾丸间质干细胞(SLC)中通过基因编辑技术来纠正致病基因突变,然后将编辑后的SLC用于自体移植,通过分化为有功能的睾丸间质细胞(LC),就能挽救遗传性原发性性腺功能减退症(HPH)。
在这项研究中,研究团队首先基于在HPH人类患者中观察到的Lhcgr无义点突变构建了LhcgrW495X突变小鼠模型。接下来,研究团队利用野生型小鼠的SLC(WT-SLC)评估了SLC移植治疗HPH的可行性。
研究团队进一步探索了不同基因组编辑工具对LhcgrW495X小鼠报告细胞和突变的SLC的编辑效率和脱靶效应。结果显示,先导编辑器——PEmax,对该突变的编辑效率最高,且没有明显的脱靶效应。
将基因编辑修正后的SLC移植到成年LhcgrW495X小鼠中,6周后小鼠血清睾酮水平达到了正常小鼠的45%左右,显著恢复了其精子发生,这表明了PEmax编辑的W495X-SLC在体内具有正常功能,并且可以挽救LhcgrW495X小鼠小鼠的HPH表型,恢复其生殖系统发育。
最后,研究团队评估了在体外经过基因编辑修正的SLC对HPH小鼠模型的治疗效果。为了评估PE-W495X-SLC移植后产生的精子是否可以支持生殖,研究团队在PE-W495X-SLC移植后6周,从雄性LhcgrW495X小鼠附睾尾获取的精子和从雌性野生型小鼠获取的卵母细胞进行了体外受精,成功产下36只子代小鼠。值得一提的是,这些子代小鼠具有正常生育能力。
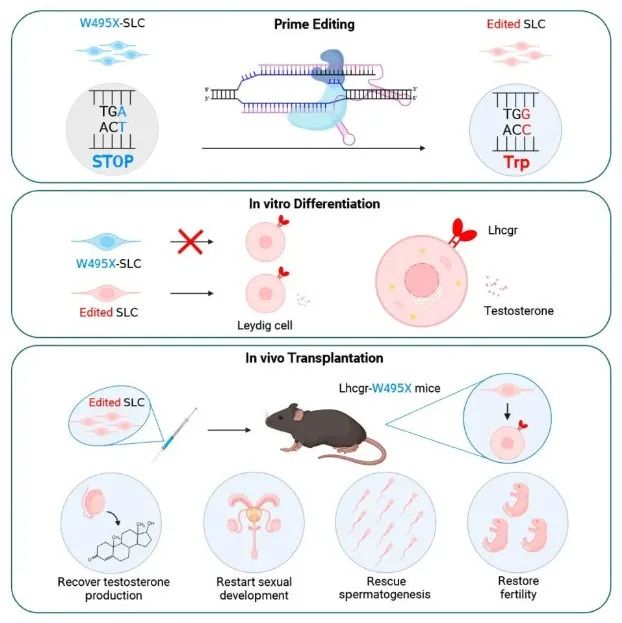
总的来说,该研究首次通过先导编辑(PE)在体外修正了LhcgrW495X小鼠的睾丸间质干细胞(SLC),将基因修正后的SLC移植到LhcgrW495X小鼠后可有效再生睾丸间质细胞(LC),进而恢复睾酮生成,重启性发育,挽救精子发生,并产生可育后代。
这些结果表明,基于先导编辑的体外SLC编辑是一种有前景的遗传性原发性性腺功能减退症(HPH)治疗策略,并有望用于治疗多种生殖系统的遗传性疾病。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


