Autophagy | 华中农业大学王湘如团队发现肺炎链球菌感染通过巨噬/自噬导致严重肺损伤
来源:生物探索 2024-05-04 14:54
该研究表明,作为pEVs的载体的细菌蛋白质StkP可以在S. pneumoniae感染期间诱导宿主自噬,并指示了革兰阳性细菌EVs在通过自噬介导的细胞降解途径引起上皮屏障破坏中的一个以前未知的作用。
华中农业大学王湘如团队在Autophagy 在线发表题为“Streptococcus pneumoniae extracellular vesicles aggravate alveolar epithelial barrier disruption via autophagic degradation of OCLN (occludin)”的研究论文,该研究观察到,小鼠感染链球菌导致严重的肺损伤和肺泡上皮屏障(AEB)功能障碍。链球菌感染降低了小鼠肺组织和A549细胞中紧密连接蛋白OCLN(occludin)的蛋白表达,并激活了巨噬细胞自噬/自噬。
在机制上,链球菌诱导自噬泡降解OCLN导致A549单层AEB损伤。链球菌释放的pEVs可以被肺泡上皮细胞内吞。通过蛋白质组学,作者对pEVs内的载体蛋白进行了分析,发现这些pEVs含有许多毒力因子,其中作者鉴定了一个类似真核丝氨酸-苏氨酸激酶蛋白StkP。内吞的StkP能够诱导BECN1(beclin 1)在Ser93和Ser96位点的磷酸化,启动自噬并导致自噬依赖的OCLN降解和AEB功能障碍。最后,在链球菌中删除stkP完全保护了感染小鼠免于死亡,显著减轻了体内OCLN降解,并在体外大部分阻断了pEVs引起的AEB破坏。总的来说,结果表明,pEVs在链球菌毒力因子的传播中发挥了关键作用。pEVs中的载体蛋白StkP能够与宿主靶蛋白通信,甚至劫持BECN1自噬启动途径,促进AEB破坏和细菌致病性。
肺炎链球菌(S. pneumoniae)是一种常见的机会性人类病原体,是全球细菌性肺炎的主要原因。该细菌每年造成数百万人死亡,导致社区获得性肺炎、败血症和脑膜炎等侵袭性肺炎链球菌疾病。S. pneumoniae通常定植于人类鼻咽和上呼吸道,但当其传播到下呼吸道时可能引发严重疾病。细菌可以通过通过肺泡上皮屏障(AEB)和血管内皮屏障而进入空气间隙进入血液,从而增加肺通透性。一般来说,肺叶炎的发展是由细菌粘附于肺泡上皮细胞,随后复制并引发宿主损伤反应所致。这些过程受到细菌分泌的产物与肺泡上皮以及随后的先天免疫防御之间的相互作用的驱动。然而,S. pneumoniae引起肺泡上皮屏障功能障碍的精确机制仍然不完全清楚。
细菌膜囊泡(MVs)被确定为一种将特定货物运输到细菌的独特分泌途径。这些MVs,也被称为外膜囊泡(OMVs),在革兰阴性细菌中得到了广泛研究和表征,但在革兰阳性细菌中研究较少。最近的研究提供了证据表明,革兰阳性细菌也可以从细胞表面释放球形膜颗粒,称为细胞外囊泡(EVs)。这些EVs通过将细菌成分输送到宿主细胞中起到了在宿主-病原体相互作用中的作用,导致细胞毒性效应,从而增加了细菌的致病性。例如,从金黄色葡萄球菌(S. aureus)衍生的EVs已被证明能够激活Toll样受体,并在上皮细胞和巨噬细胞中诱导促炎细胞因子反应。尽管已观察到EVs内化到上皮和内皮细胞中会增加屏障通透性,但关于EVs如何破坏AEB完整性的证据仍然缺乏。
巨噬/自噬是一种保守的溶酶体降解途径,可清除损伤的细胞器和蛋白质,从而避免多种细胞和器官的过度损伤和细胞功能障碍。一方面,自噬可以作为对外部刺激的保护性反应,例如缺氧下,它有助于防止内皮CLDN5的重新分布和异常积聚,从而减轻BBB功能障碍。然而,另一方面,过度的自噬会导致自噬细胞死亡,导致组织损伤。研究表明,自噬可以降解紧密连接蛋白(TJ蛋白)并增加肠道和呼吸道上皮屏障通透性。也有报道称,S. pneumoniae感染可以在人类肺泡上皮细胞(AECs)、人类角膜上皮细胞和小鼠骨髓来源的中性粒细胞中诱导自噬激活。细胞内的S. pneumoniae可以被细菌杀伤性自噬所识别,并且某些S. pneumoniae来源的蛋白质被认为是自噬激活剂,例如表面暴露的胆碱结合蛋白CbpC、形成孔的毒素肺炎链球菌裂素PLY和S. pneumoniae内切蛋白O PepO。然而,与S. pneumoniae感染相关的与自噬有关的AEB破坏的直接证据和基本机制仍然未知,并且S. pneumoniae EVs(pEVs)对这些自噬过程的操纵尚未被探索。
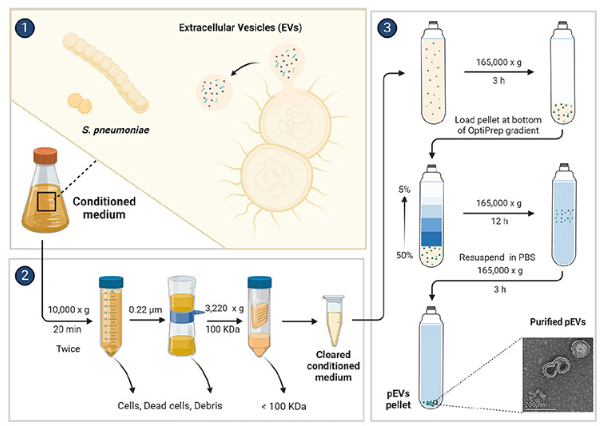
从肺炎链球菌D39株中分离、纯化和鉴定pEvs的程序示意图(Credit: Autophagy)
该研究证明了pEVs可以诱导肺泡上皮细胞中的自噬,导致AEB完整性的破坏。作者还发现pEVs在A549细胞中的内化导致MAP1LC3/LC3(微管相关蛋白1轻链3)-II的增加,这是自噬激活和自噬体形成的标志,以及通过自噬过程的OCLN(occludin)的降解。此外,作者确定了类似真核丝氨酸-苏氨酸激酶(eSTKs)蛋白StkP包含在pEVs中,内部的StkP发现诱导通过磷酸化BECN1(beclin 1)的自噬激活。
综上所述,该研究表明,作为pEVs的载体的细菌蛋白质StkP可以在S. pneumoniae感染期间诱导宿主自噬,并指示了革兰阳性细菌EVs在通过自噬介导的细胞降解途径引起上皮屏障破坏中的一个以前未知的作用。总的来说,这些结果提高作者对pEVs及其载体对屏障破坏的细胞内影响的理解,为细菌致病性和宿主疾病进展提供了见解。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


