癌症免疫周期的代谢调节
来源:本站原创 2021-10-27 10:08
癌症免疫周期(CIC)包括一系列免疫介导控制肿瘤生长所需的事件。阻断CIC的一个或多个步骤可以使肿瘤逃避免疫监测。
癌症免疫周期(CIC)包括一系列免疫介导控制肿瘤生长所需的事件。阻断CIC的一个或多个步骤可以使肿瘤逃避免疫监测。然而,通过重新激活CIC来恢复抗肿瘤免疫的尝试迄今为止收效有限。近年来,大量研究表明肿瘤微环境(TME)中肿瘤和免疫细胞的代谢重编程是免疫逃逸的关键因素。
因此,作者认为肿瘤发生过程中细胞代谢的改变促进了CIC的启动和破坏。作者还提供了代谢靶向TME的理论基础,这可能有助于提高肿瘤对嵌合抗原受体(CAR)转导的T细胞或免疫检查点封锁(ICB)疗法的响应性。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34610889/
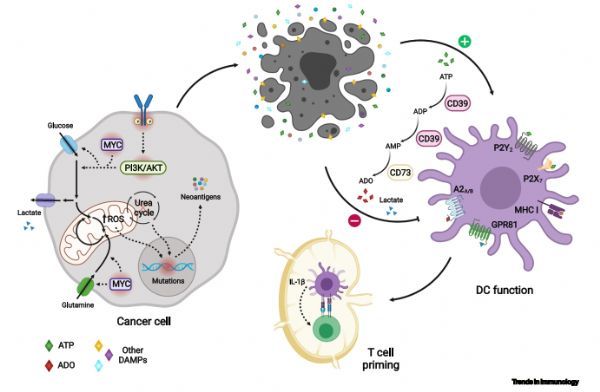
最佳的抗癌免疫反应需要一系列的事件,统称为CIC。这个周期是由死亡的癌细胞释放癌症相关抗原(CAAs)开始的。在哺乳动物中,这些抗原被树突状细胞(DCs)捕获并加工,然后呈现给肿瘤引流淋巴结内的naïve T细胞。活化的肿瘤抗原特异性CD8+ T细胞动员并浸润肿瘤,它们通过识别与癌细胞表面MHC I类分子结合的同源肽抗原(pmc)识别并消灭癌细胞。随后释放额外的CAAs启动新一轮CIC,并在随后的每一轮中增强免疫反应的强度。干扰一个或多个CIC事件使肿瘤能够逃避免疫介导的破坏,这是癌症的一个标志。
一般来说,肿瘤通过降低免疫原性或抑制肿瘤浸润T细胞的效应能力来干扰CIC。通过合成car -转导T细胞或通过ICB恢复CD8+ T细胞的效应能力来增加对肿瘤的免疫识别,旨在逆转这些适应机制的疗法,在过去的十年中,已经导致了具有里程碑意义的临床反应,从而彻底改变了癌症免疫治疗领域。然而,大多数患者对免疫治疗表现出最小或暂时的反应,这表明肿瘤在多个点上中断了CIC。在这里,作者提出肿瘤代谢的改变是肿瘤免疫原性和免疫逃避的基本驱动因素,并讨论了靶向肿瘤代谢如何恢复功能性CIC和促进持久的抗肿瘤免疫。
为了激活宿主免疫反应,肿瘤必须在激活DC功能和适当的淋巴结启动的环境下产生和释放异常肽。由于环境突变,如肺癌或黑素瘤,或内源性DNA修复途径的损伤,如错配修复(MMR)缺陷肿瘤,已经提出,充分的肿瘤免疫原性需要高突变率。另外,作者认为代谢重组对肿瘤生长至关重要,这从根本上导致了肿瘤的免疫原性。在这里,作者描述了伴随转化的代谢改变如何成为组成CIC初始阶段元素的驱动因素。
驱动癌细胞生长的致癌途径的激活如何促进免疫原性?现在已经确定,不依赖生长因子的营养摄取超过ATP产生的需要是肿瘤发生的标志。的确,高葡萄糖摄取率是基于18-氟脱氧葡萄糖(FDG)摄取的肿瘤正电子发射断层显像(PET)的基础。肿瘤发生过程中营养摄取的增加不仅限于葡萄糖,大多数肿瘤中谷氨酰胺的高摄取率证明了这一点。生长因子独立的营养摄取通常由磷酸肌醇-3激酶(PI3K)和MYC通路的致癌激活驱动,这是人类癌症中最常见的改变途径之一。
营养摄取的增加如何导致突变?癌基因驱动的营养摄取导致线粒体活性氧(ROS)的积累,这与染色质重塑结合,可导致突变率的增加。因此,无法中和癌基因依赖的ROS导致细胞衰老的激活和炎症因子的分泌,从而启动免疫反应。这得到了多项研究的支持,包括在体外模型中,正常人类成纤维细胞中过表达致癌MYC和RAS变异诱导ros依赖性细胞衰老,以及体外数据显示,致癌kras诱导的ROS可增加小鼠及急性髓系白血病、慢性髓系单核细胞白血病和幼年髓系单核细胞白血病患者髓系细胞IL-1β的分泌。
相反,通过促进kelch样ECH相关蛋白1 (KEAP1)失活或核因子红系2相关因子2 (NRF2)的突变来稳定肿瘤固有的抗氧化程序,可以使肿瘤对ICB不敏感。通过分析使用抗程序性细胞死亡配体1 (PD-L1)单克隆抗体atezolizumab治疗的非小细胞肺癌(NSCLC)患者的转录组数据,证实了这一点。因此,癌基因驱动的营养摄取的增加可以促进突变,从而通过增加某些癌症细胞内ROS的积累来增强免疫原性。
肿瘤免疫原性代谢调节模型:肿瘤细胞生长所需的致癌驱动的代谢重组可促进肿瘤免疫原性。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34610889/
对TME代谢重编程如何增强免疫原性和免疫逃避的日益深入的了解,为增强抗肿瘤免疫提供了大量潜在的新策略。在这里,作者聚焦于特定细胞类型(如癌细胞、DCs、CD8+ T细胞和treg)的代谢重组如何调节肿瘤免疫原性和抑制抗肿瘤免疫。在CIC中,作者涵盖了在这些细胞类型的功能中发挥突出作用的各种代谢途径,额外的代谢途径,如脂质摄取、合成和代谢,以及额外的应激反应途径,包括内质网应激途径,新兴的CIC关键调制器是否值得进一步探索。
此外,TME中额外的非恶性细胞(如CAFs、内皮细胞、TAMs和MDSCs)的代谢重编程如何调节CIC是一个重要的研究领域,可能揭示额外的治疗靶点。这些可能包括本文描述的免疫抑制代谢酶,通常由基质细胞在TME中表达。
此外,细胞代谢重编程对CIC内其他事件的影响,如T细胞募集和肿瘤浸润,可能提供策略来逆转在多重免疫治疗难治性肿瘤中观察到的所谓T细胞排斥表型。进一步研究细胞类型和肿瘤类型特异性代谢重编程及其如何促进细胞外TME代谢重构是一个富有成果的研究领域。
作者认为,更深入地了解肿瘤细胞中特定的代谢重编程如何支持免疫逃避将是临床上预防免疫检查点抑制剂抵抗的关键。最后,对CAR-T细胞或ICB治疗患者的代谢网络进行广泛的分析,可以扩大对联合使用假定靶点的识别,并在理想情况下改善患者对此类治疗的反应。(生物谷
Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。