Nature子刊:岑山/余利岩/郭斐合作发现**微生物来源PROTAC分子
来源:生物世界 2022-04-29 14:46
PROTAC
PROTAC(Proteolysis-Targeting Chimera)技术,通过把E3泛素连接酶和目标蛋白联系在一起,导致目标蛋白的泛素化修饰,从而被蛋白酶体分解成多肽和氨基酸。目标蛋白被降解后,PROTAC会被释放重用,继续破坏目标蛋白。
相比于其他的药物和疗法,PROTAC有许多潜在的优势,比如其组织分布广泛,可以口服给药。相比于其他疗法(如细胞治疗、抗体药物等),PROTAC的生产流程更简单;相比小分子药物,PROTAC可以靶向其更多小分子药物无法靶向的靶点,产生更好的效果。
最近几年,PROTAC技术飞速发展,已被证明是最具潜力、最有突破性的药物研发技术之一。目前报道的PROTAC主要靶向CRBN与VHL等E3连接酶,发现新的可利用的E3连接酶并开发相应的PROTAC具有重要意义,但也面临着巨大挑战。
中国医学科学院医药生物技术研究所岑山研究员、余利岩研究员、病原生物学研究所郭斐研究员作为共同通讯作者,在 Nature Communications 期刊在线发表了题为:An anti-influenza A virus microbial metabolite acts by degrading viral endonuclease PA 的研究论文。
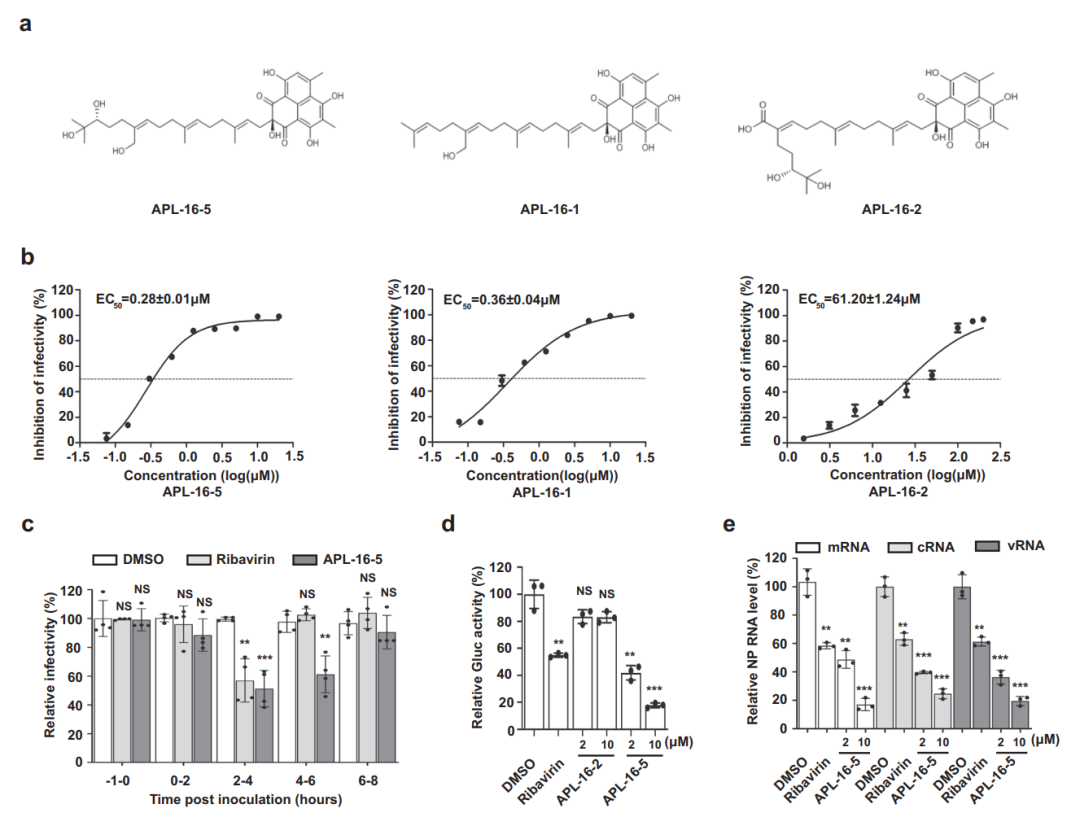
该研究发现了微生物天然产物 APL-16-5 同时结合 E3 泛素连接酶 TRIM25 和流感病毒 PA 亚基,基于 PROTAC 机制,诱导TRIM25依赖的PA泛素化及其降解,阻断病毒RNA复制,具有良好的体内抗甲型流感病毒活性。
该研究发现了第一个来源于微生物天然产物的PROTAC分子,表明微生物代谢产物可成为发现天然PROTAC分子的重要来源。
APL-16-5作为第一种体内高效抗病毒的PROTAC分子,具有发展成为新型抗流感药物的潜力,以解决目前流感病毒的抗原漂移和耐药问题。特别是该项研究首次提出和验证了TRIM25可以作为PROTAC技术应用的新E3泛素化连接酶。鉴于TRIM超家族是体内最大的E3泛素化连接酶家族之一(近80个成员),其在药物研发中的应用有可能极大地扩展PROTAC技术发展潜力。同时,APL-16-5及其衍生物可作为TRIM25配体,推动基于TRIM25的新PTOTAC分子设计,进一步拓展其应用范围。
中国医学科学院医药生物技术研究所岑山研究员、余利岩研究员和中国医学科学院病原生物学研究所郭斐研究员为论文的共同通讯作者,赵建元助理研究员、王静副研究员和庞旭副研究员为共同第一作者。病原所郭斐研究员团队和中科院微生物所邓涛团队协助了课题的开展。该研究由国家自然科学基金、国家科技资源共享服务平台、重大新药创制、中国医学科学院医学与健康科技创新工程基金、以及中央级公益性科研院所基本科研业务费等资助完成。APL-16-5是由国家菌种资源库中国药学微生物菌种保藏管理中心自行分离的植物内生菌 Aspergillus sp. CPCC 400735产生。
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->