Cell Rep:揭示阿尔兹海默病的最大遗传风险因素或有望帮助寻找新型药物靶点
来源:生物谷原创 2023-10-30 11:55
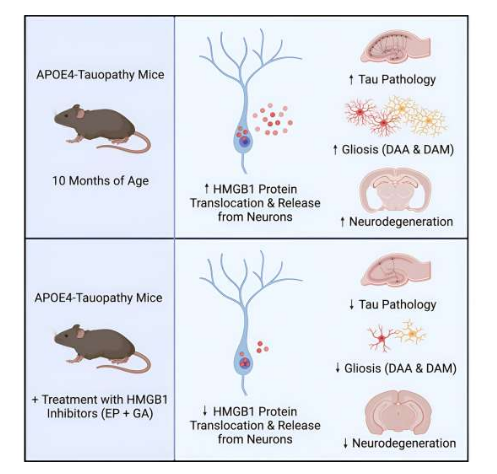
来自Gladstone研究所等机构的科学家们通过研究发现,产生APOE4的神经元所释放的名为HMGB1的免疫信号分子的速率要比产生其它APOE突变体的神经元高得多。
如果你是近25%携带APOE4基因突变的个体之一,那么其患阿尔兹海默病的风险就要高出平均水平,但是,尽管长期以来科学家们知道APOE4会导致大脑发生改变,从而导致痴呆症发生,但这种影响效应背后确切的分子机制,研究人员并不清楚。近日,一篇发表在国际杂志Cell Reports上题为“APOE4-promoted gliosis and degeneration in tauopathy are ameliorated by pharmacological inhibition of HMGB1 release”的研究报告中,来自Gladstone研究所等机构的科学家们通过研究发现,产生APOE4的神经元所释放的名为HMGB1的免疫信号分子的速率要比产生其它APOE突变体的神经元高得多,当HMGB1被释放后,其就会激活称之为小胶质细胞的大脑免疫细胞,从而诱发神经元炎症和退化的发生。
正如研究人员在文章中描述的那样,当他们利用两种试验药物的混合制剂阻断HMGB1的释放时,产生APOE4和其它促痴呆因素的小鼠模型的大脑中小胶质细胞激活和神经变性就会少得多。医学博士Yadong Huang说道,我们非常惊讶和兴奋,靶向作用这一途径会产生较强的保护性作用从而抵御APOE4所驱动的神经变性,同时还能帮助回答这一领域长期存在的问题,即APOE4诱导的神经炎症在阿尔兹海默病中所扮演的关键角色,同时还有望指出治疗这一疾病的新方法。
在大脑中,阿尔兹海默病会对不同的细胞类型产生不同的影响效应,与疾病相关的改变包括tau蛋白和淀粉样蛋白的积累,小胶质细胞的激活会促进炎症发生以及神经元的退化和最终死亡;然而科学家们一直并不确定到底是哪一种诱发了其它的发生;或许是神经元先退化,随后诱发小胶质细胞的激活,但也有可能是小胶质细胞首先被激活,随后再诱发神经变性;为了回答这个先有鸡还是先有蛋的问题,研究人员调查了在APOE4背景下小胶质细胞的激活,长期以来他们一直将APOE4认为是诱发阿尔兹海默病的主要风险因素。APOE4是APOE基因的三个版本之一,携带一种APOE4基因拷贝的个体(几乎占到了四分之一的人口)患阿尔兹海默病的可能性是携带更常规版本APOE3个体的3.5倍,而携带两个APOE4拷贝的个体(大约在人群中占到了3%的比例)的患病风险却增加了12倍。
揭示阿尔兹海默病的最大遗传风险因素或有望帮助寻找新型药物靶点。
图片来源:Cell Reports (2023). DOI:10.1016/j.celrep.2023.113252
于是研究人员就想知道是否携带APOE4突变体的神经元能产生任何一种能激活小胶质细胞的型号分子,随后他们很快锁定了免疫分子HMGB1,其被认为能在某些癌症和感染中诱发强烈的炎性反应。在早期实验中,研究人员观察了携带APOE3或APOE4突变体的阿尔兹海默病小鼠模型大脑神经元中HMGB1分子的位置,研究人员观察到了非常惊人的模式,当携带APOE4的神经元暴露于压力中时,HMGB1就会从细胞核转移到细胞质中,随后就会被释放到细胞外空间中,而在携带APOE3的神经元中,HMGB1则会留在细胞核中。对小鼠模型进行的额外研究结果表明,从神经元中选择性地移除APOE4就能阻断HMGB1从神经元中的释放,从而就巩固了神经元APOE4与HMGB1释放之间的关联。
最后,研究人员研究了两种实验性药物阻断HMGB1释放所产生的影响效应,他们发现,在产生APOE4的痴呆症相关小鼠模型中,两种药物的混合或能降低小胶质细胞的激活以及神经变性的发生。这或许是一个非常明确的结果,当阻断HMGB1从神经元“出口”时,或许就能保护小鼠免于阿尔兹海默病病理学表现的不同方面。APOE4对神经元会产生其它影响,但根据研究发现,研究人员推测,如果没有小胶质细胞的激活,这些其它的影响效应或许并不足以导致神经变性的发生,因此,研究人员认为,靶向作用HMGB1的药物最终或能被用来预防或治疗APOE4相关的阿尔兹海默病。
最后研究者表示,这些小分子已经在临床试验中被用于治疗其它人类疾病,因此其或许有望很快进入到人类的临床试验中,目前研究人员正在继续研究并探索其它方法,包括新药等,他们想以HMGB1为靶点,从神经元中对其释放并研究其对小胶质细胞的影响效应。(生物谷Bioon.com)
原始出处:
Nicole Koutsodendris et al, APOE4-promoted gliosis and degeneration in tauopathy are ameliorated by pharmacological inhibition of HMGB1 release, Cell Reports (2023). DOI: 10.1016/j.celrep.2023.113252
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


