FDA批准多重碱基编辑CAR-T临床试验申请
来源:生物世界 2022-12-05 16:12
总的来说,这些临床前研究显示,胞嘧啶碱基编辑(CBE)是一种很有前途的技术,基于CBE开发的四重编辑CAR-T细胞7CAR8,具有治疗复发或难治性急性T淋巴细胞白血病(T-ALL)潜力。
Beam Therapeutics宣布FDA已解除对其基于碱基编辑的CAR-T细胞疗法BEAM-201的临床搁置,批准了BEAM-201用于治疗复发/难治性T淋巴细胞白血病(T-ALL)和T淋巴母细胞淋巴瘤(T-LL)的IND申请。

BEAM-201是Beam Therapeutics开发的基于胞嘧啶碱基编辑(Cytosine Base Editor,CBE)的针对CD7靶点的四重碱基编辑CAR-T细胞疗法,该疗法专为同种异体CAR-T细胞而设计。
Beam的首席执行官 John Evans 表示,FDA批准了BEAM-201的IND申请,对Beam和基因编辑领域来说是一个令人兴奋的时刻,因为它代表了一种多重碱基编辑的试验药物的首个IND批准。我们相信多重碱基编辑技术能够支持未来细胞治疗对高水平细胞工程的需求。结合四种重高效碱基编辑,BEAM-201有潜力对这些具有挑战性的T细胞肿瘤患者产生重大影响,这些患者当前缺乏创新的、新的治疗方案。我们很高兴获得这一许可,使我们能够将这种新药物推进到人体临床试验,期待在2023年提供该项目进一步更新。
此前,2022年8月1日,碱基编辑公司 Beam Therapeutics 宣布其BEAM-201的IND申请被FDA暂停,并自随后要求Beam公司进一步提供:
1、来自基因组重排评估的额外对照数据;
2、对某些脱靶编辑实验的进一步分析
3、细胞因子非依赖性生长试验的额外对照数据;
4、更新的研究者手册,其中包括有关任何新的非临床研究的信息。
从上述要求来看,FDA对 BEAM-201 疗法的担忧是多么方面的,其中包括了对Beam公司的碱基编辑技术本身的潜在风险和脱靶性的担忧。除了要解决FDA提出的问题外,Beam公司还在报告中表示,需要进行比预期更多的基因编辑才能实现异体CAR-T细胞疗法。这也意味着Beam公司今年将不再推进其另一款CAR-T疗法进入临床。
今年6月份,Beam向FDA提交了BEAM-201疗法在治疗复发或难治性T-ALL(急性T淋巴细胞白血病)和其他CD7阳性恶性肿瘤的治疗效果,这也是首个同时编辑了4个基因的CAR-T疗法。
2017年10月,FDA批准了首款CAR-T细胞疗法上市,人类进入细胞治疗时代,CAR-T细胞疗法在血液类癌症中取得了很好的临床效果。
目前,已上市的几款CAR-T细胞疗法都是使用来自癌症患者自身的自体T细胞,自体细胞疗法的优势在于能够在患者体内长时间发挥作用,且不产生排异反应,但该方法也存在着许多局限性,自体细胞疗法耗时长,一些急性白血病患者没有足够时间等待,此外,许多严重患者本身没有足够的T细胞用于工程化改造。
因此,由健康捐赠者来源的T细胞构建的CAR-T可以避免上述问题,并可能开发出“现货型” CAR-T产品。但实际上,让身体“相信来自别人的细胞”并非易事,这需要对CAR-T细胞进行额外的修饰,以防止移植物抗宿主病(GvHD)以及身体对CAR-T细胞的排斥。
目前已经有不少研究及一些临床试验使用CRISPR-Cas9基因编技术来构建同种异体的“现货型” CAR-T细胞。但其中一个需要特别注意的问题是,CRISPR-Cas9依赖于DNA双链断裂(DSB)来发挥基因编辑作用,这可能会导致许多意料之外的后果,从而影响这种方式生产的“现货型” CAR-T的实用性、安全性和获批。
2022年5月16日,碱基编辑公司 Beam Therapeutics 与美国费城儿童医院合作,在血液学顶级期刊 Blood 发表了题为:Cytosine Base Editing Enables Quadruple-Edited Allogeneic CAR-T Cells for T-ALL 的研究论文。
该研究使用胞嘧啶碱基编辑(Cytosine Base Editing,CBE)构建了针对CD7靶点的四重碱基编辑CAR-T细胞——7CAR8,专为同种异体CAR-T细胞而设计。并在临床前动物模型中证实了7CAR8对复发或难治性T-ALL(急性T淋巴细胞白血病)和其他CD7阳性恶性肿瘤的治疗效果。
据悉,这也是首个同时编辑了4个基因的CAR-T疗法,目前这款疗法已进行IND申报,将在今年下半年开展人体临床试验。

碱基编辑(Base Editing)是由刘如谦(David Liu)等人开发并逐步扩展、完善的一种新兴基因编辑技术,碱基编辑能够在特定点以高精度和高效率对单个碱基对进行编辑,且不依赖DNA双链断裂(DSB),因此被认为相比于CRISPR-Cas9具有更高的安全性。
2018年,刘如谦、J. Keith Joung 和张锋等人联合创立了 Beam Therapeutics,致力于将碱基编辑技术应用于疾病治疗。该公司于2020年2月在纳斯达克上市。

为了确定基于碱基编辑的CAR-T在临床上是否可行,Beam Therapeutics 与费城儿童医院的癌症专家Caroline Diorio研究员合作,验证基于碱基编辑的现货型CD7-CAR-T细胞治疗复发或难治性急性T淋巴细胞白血病(T-ALL)的安全性和效果。
该疗法使用的靶点为CD7,它在绝大多数T-ALL细胞(95%)中高表达,然而,健康 T 细胞同样也表达CD7,这就会导致CAR-T细胞在杀伤T-ALL的同时,也会自相残杀。
为了避免CAR-T细胞的自相残杀,Beam通过碱基编辑,敲除CAR-T细胞表面的CD7。同时敲除TRAC(T细胞受体α恒定区),清除T细胞表面受体,避免移植物抗宿主病(GvHD),敲除CD52,避免患者对CAR-T细胞的排异反应,还敲除了PD-1,提高CAR-T细胞抗肿瘤活性的持久性。从而成功构建了7CAR8。
实验结果显示,平均92.9%的T细胞在四个预期目标位点进行了碱基编辑,81.4%的在四个位点都进行碱基编辑的T表达了CAR结构。
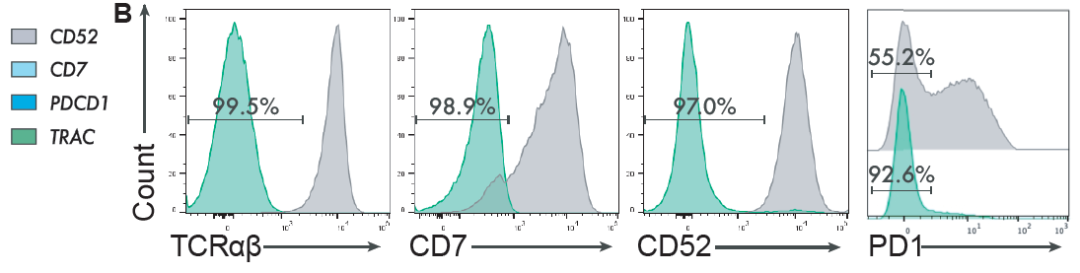
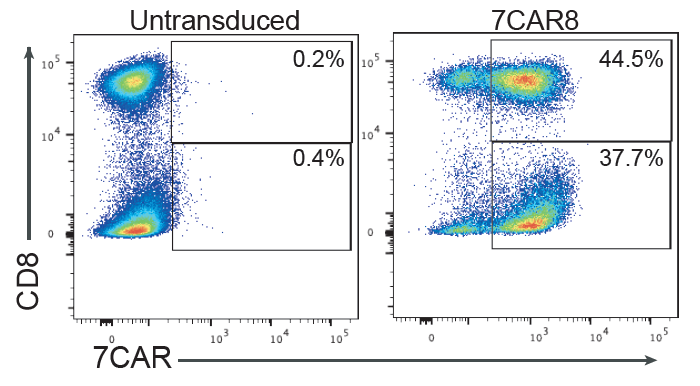
与CRISPR-Cas9不同,胞嘧啶碱基编辑(CBE)没有影响T细胞增殖,也不会导致异常的DNA损伤反应通路激活或导致多重编辑后的细胞核型异常。
在多项体内和体外临床前研究中,研究团队观察到7CAR8高度活跃,对T细胞急性淋巴细胞白血病(T-ALL)非常有效,能够高效清除小鼠体内癌细胞并显著延长生存期。
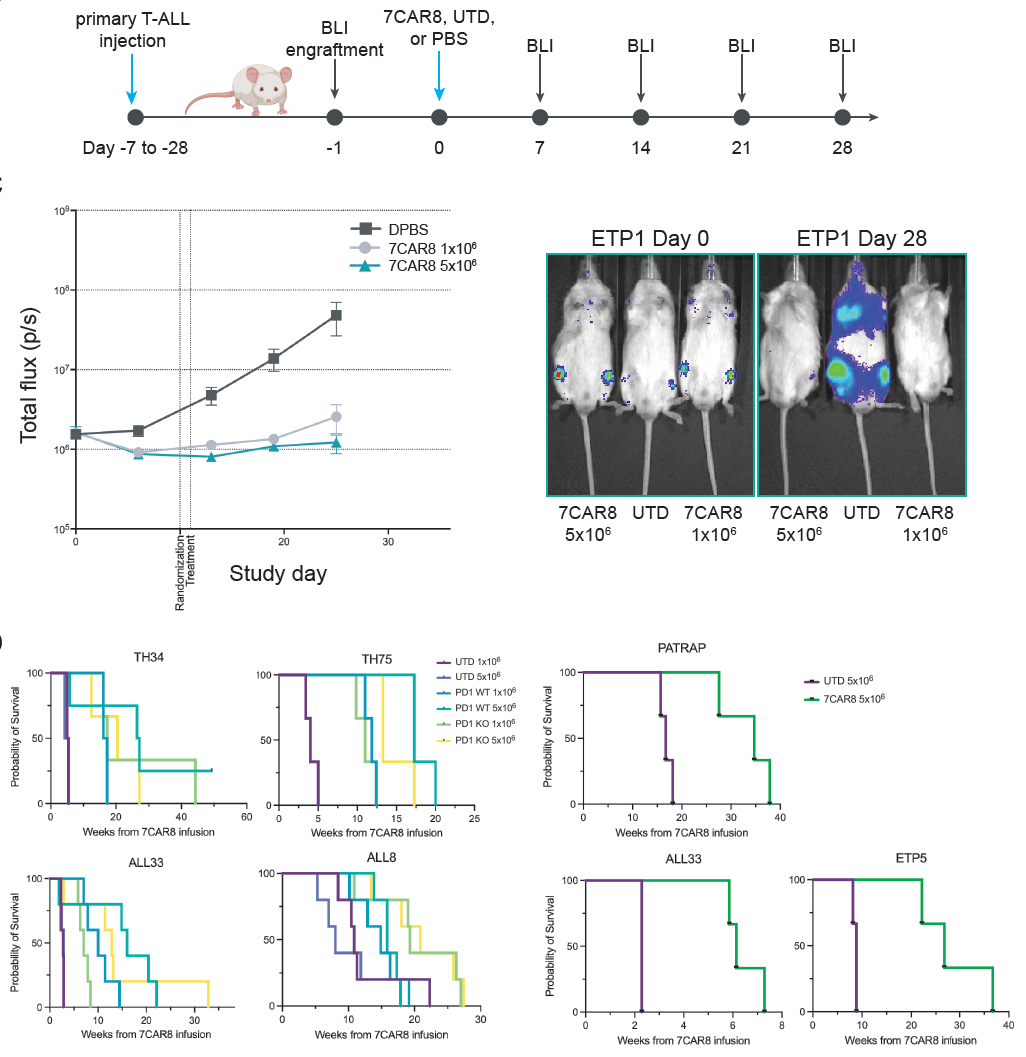
总的来说,这些临床前研究显示,胞嘧啶碱基编辑(CBE)是一种很有前途的技术,基于CBE开发的四重编辑CAR-T细胞7CAR8,具有治疗复发或难治性急性T淋巴细胞白血病(T-ALL)潜力。该疗法还具有治疗其他CD7阳性恶性肿瘤的潜力,例如急性髓细胞白血病(AML)、T淋巴母细胞性淋巴瘤(TLBL)等。
这项研究也为开发“现货型 ”CAR-T疗法指明了方向。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


