老了,心脏不给力了?或许真有办法逆转!Nat Commun:棕色脂肪因子12,13-diHOME通过抑制CaMKII延缓心脏衰老
来源:生物谷原创 2025-08-26 11:29
本研究首次系统揭示了12,13-diHOME作为BAT分泌的关键脂因子,在衰老过程中通过抑制CaMKII活性、缓解内质网应激从而显著改善心脏功能的作用机制。
“爸,您这爬一楼就气喘的毛病,是不是该去查查心脏?”、“妈,降压药又加量了?医生说您的左心室有点厚……” 想必不少人对这样的对话并不陌生。随着我国 60 岁以上人口占比突破 20%,“老年心血管健康” 早已不是医学期刊里的冷僻话题,而是每个家庭都可能面临的现实挑战。
我们总以为,心脏功能随年龄衰退就像头发变白一样不可逆 —— 收缩力下降、心室变厚、稍微活动就心慌气短,但最新发表在《Nature Communications》的研究,或许要给这份 “认命” 画上问号。
这篇研究的主角,是一种名叫 12,13-diHOME 的小分子物质,它来自我们曾经以为 “只负责产热减肥” 的棕色脂肪组织(BAT)。研究团队发现,这种物质会随年龄增长减少,而补充它或移植年轻的棕色脂肪,竟然能让老年小鼠的心脏 “重返青春”。更有意思的是,它的作用机制像一把精准的 “分子剪刀”,专门剪断衰老给心脏套上的 “枷锁”。这不仅为老年心血管病提供了新疗法思路,更颠覆了我们对 “脂肪” 的认知——原来有些脂肪,是心脏的 “贴心保镖”。

实验对象
研究团队首先在 “人” 和 “小鼠” 中做了对比观察:
人类样本:7 名 18-35 岁青年和 12 名 65-90 岁老人的血浆;
小鼠样本:3 月龄(青年)和 18 月龄(相当于人类 60 岁以上)雄性小鼠的血浆,以及 21-24 月龄的老年雌雄小鼠(用于后续干预实验),甚至还有 nNOS 基因敲除小鼠(用来验证作用通路)。
这么设计的原因是:先确认 “12,13-diHOME 随年龄减少” 是跨物种的普遍现象,再用小鼠做干预实验,因为小鼠的基因和生理结构更适合精准探究机制。
实验流程与结论
研究团队像剥洋葱一样,层层递进地展开实验:
第一步:先看看 “衰老” 会偷走哪些物质
他们用液相色谱 - 质谱(LC-MS/MS)分析了青年和老年人类、小鼠的血浆脂质,重点关注有信号功能的脂类。结果发现,在人类中,19 种脂质随年龄变化,其中 9 种减少;在小鼠中,31 种脂质减少,1 种增加。而 12,13-diHOME 是为数不多在两种物种中都显著减少的物质——青年人体内的 12,13-diHOME 水平明显高于老人,小鼠也是如此。这一步暗示:12,13-diHOME 可能是 “对抗心脏衰老” 的关键信号。
第二步:给老年小鼠 “装个年轻的 BAT”,心脏会变好吗?
既然 12,13-diHOME 来自 BAT,那移植年轻的 BAT 会不会有效?研究人员将 3 月龄小鼠的 BAT 移植到 21 月龄老年小鼠的腹腔内,12 周后用超声心动图检测。结果惊艳:移植了 BAT 的老年雌雄小鼠,射血分数(反映心脏收缩功能)明显提高,左心室后壁厚度(反映心肌肥厚)变薄,肥厚指数(心室壁厚度 / 舒张期直径)也降低了。更重要的是,心脏的收缩和舒张功能(用 ±dP/dt 衡量)也恢复了,就像给衰老的心脏加了 “助推器”。
为了证明这是 BAT 的 “专属功劳”,他们还做了对照:移植同龄小鼠的白色脂肪(pgWAT),结果心脏功能毫无改善。这说明,不是随便一块脂肪都有用,只有 BAT 才有 “护心特效”。
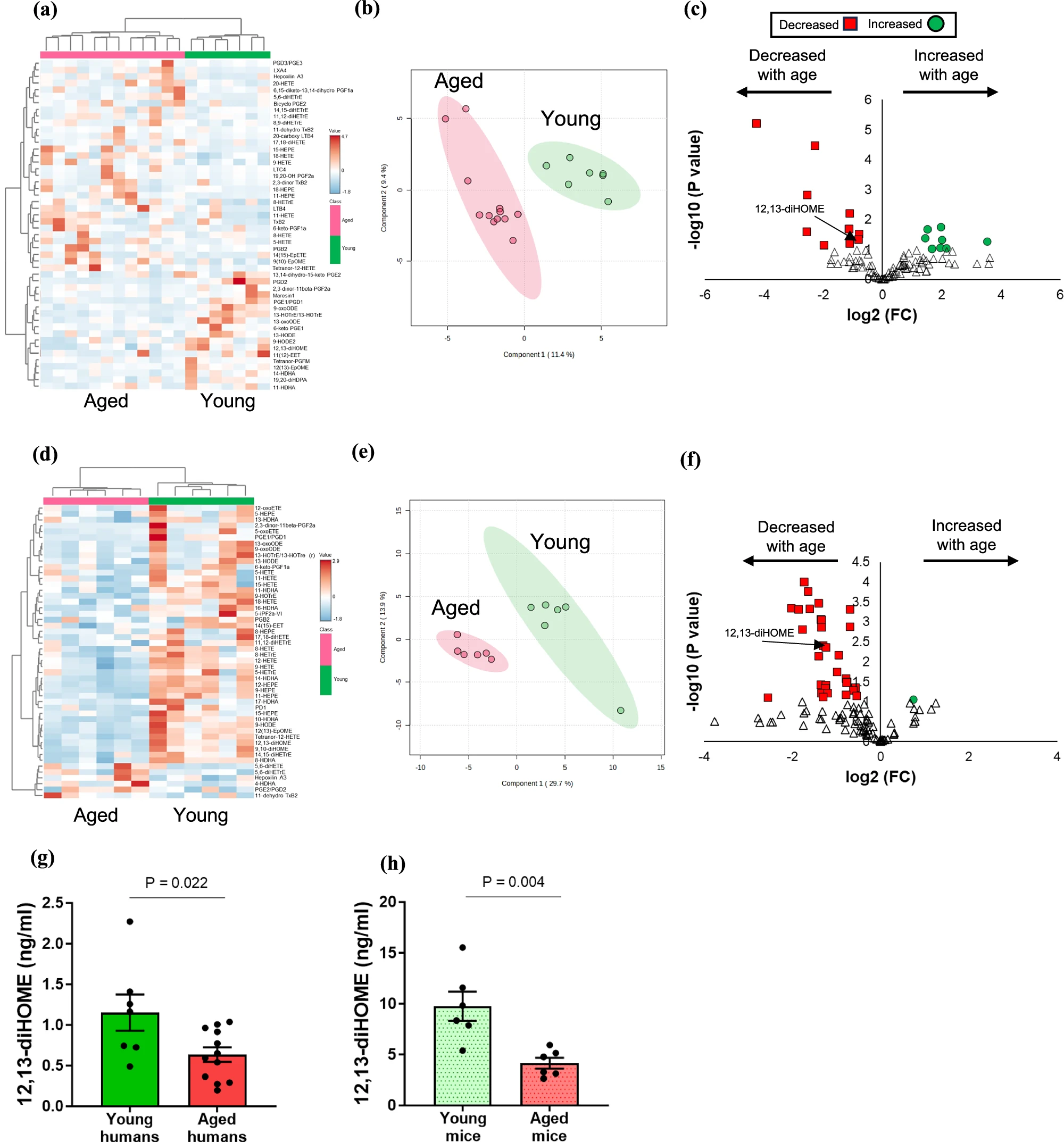
人类和小鼠机体的循环脂质随着年龄的增长而改变
第三步:直接补 12,13-diHOME,效果和 BAT 移植一样吗?
BAT 移植的好处,会不会就是因为它能分泌 12,13-diHOME?研究人员检测了移植 BAT 的小鼠血浆,发现 12,13-diHOME 水平确实升高了。于是他们直接给老年小鼠注射 12,13-diHOME,发现雄性小鼠的心脏收缩和舒张功能立刻改善,但雌性小鼠没反应。
不过 12,13-diHOME 半衰期很短,30 分钟就会被代谢掉。为了实现 “持续补充”,研究团队用了一种叫 “组织纳米转染(TNT)” 的技术:通过皮肤导入能表达 Ephx1 和 Ephx2 的质粒(这两种酶能促进 12,13-diHOME 合成),每周一次,持续 6 周。结果更惊喜:这种方法让老年雌雄小鼠的 12,13-diHOME 水平稳定升高,心脏功能(射血分数、心室厚度等)都得到改善。看来,只要让 12,13-diHOME “常驻体内”,雌雄小鼠都能受益。
第四步:12,13-diHOME 是怎么让心脏变年轻的?
为了找机制,研究团队对老年小鼠的心脏做了 RNA 测序(RNA-Seq)。结果发现,老年小鼠心脏里,与内质网应激(ER stress)和细胞外基质(比如纤维化)相关的基因表达飙升,而 BAT 移植或补充 12,13-diHOME 后,这些基因的表达在雄性小鼠中明显下降。
内质网应激就像心脏细胞里的 “工厂故障”—— 负责蛋白质加工的内质网出问题,会引发细胞功能紊乱,甚至凋亡;而纤维化则像心脏里长了 “疤痕”,让心室变僵硬。研究人员进一步验证:BAT 移植或 TNT 上调 12,13-diHOME 后,雄性小鼠心脏中内质网应激的标志物(比如 sXBP1/uXBP1 比值)降低,血管周围的纤维化也减少了。但雌性小鼠的内质网应激本来就比雄性低,所以 12,13-diHOME 对她们的这一通路影响不大——这解释了为什么急性注射只对雄性有效。
第五步:最终的 “分子开关” 是谁?
心脏的钙离子循环紊乱是衰老的核心问题,而钙调蛋白依赖的蛋白激酶 II(CaMKII)是调控钙离子的 “关键开关”,它过度激活(磷酸化)会导致心脏功能异常。研究团队发现,12,13-diHOME 能直接抑制 CaMKII 的磷酸化(pCaMKII):
体外实验中,12,13-diHOME 在 micromolar 浓度下就能抑制 CaMKII 活性;
微尺度热泳(MST)实验显示,它能直接结合 CaMKIIδ,解离常数(Kd)在 19-24μM 之间,说明是 “特异性结合”;
在小鼠体内,注射 12,13-diHOME 后,心脏中 pCaMKII 水平显著下降。
更关键的是,这种作用依赖于 nNOS 基因 —— 在 nNOS 敲除小鼠中,即使 12,13-diHOME 水平升高,也无法改善心脏功能或降低内质网应激。这说明,12,13-diHOME 的 “护心术”,必须通过 nNOS 这条通路。
小结
综上,本研究首次系统揭示了12,13-diHOME作为BAT分泌的关键脂因子,在衰老过程中通过抑制CaMKII活性、缓解内质网应激从而显著改善心脏功能的作用机制,其创新之处不仅在于发现了这一新型“抗衰老脂因子”,更在于利用前沿的TNT技术实现了其长效、可控的表达,为临床转化提供了可能。
然而,该研究也提示了显著的性别差异,即雄性小鼠更依赖于12,13-diHOME-CaMKII-ER应激轴,而雌性则可能通过其它通路受益,这一发现呼吁未来研究需更加关注性别特异性治疗策略的开发。总之,这项研究不仅为理解脂肪—心脏轴在衰老中的作用提供了深刻见解,也为开发针对老年心血管疾病的精准疗法奠定了坚实的理论基础。(生物谷Bioon.com)
参考文献:
Nirengi, S., Buck, B., Das, D. et al. 12,13-diHOME protects against the age-related decline in cardiovascular function via attenuation of CaMKII. Nat Commun 16, 7088 (2025). doi:10.1038/s41467-025-62474-7
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


