2022年4月Science期刊精华
来源:生物谷原创 2022-05-08 11:03
2022年4月份即将结束了,4月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2022年4月份已经结束,4月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:肿瘤细胞激活DNA断裂,从而在基因毒性治疗中存活下来
doi:10.1126/science.abi6378
在一项新的研究中,来自丹麦哥本哈根大学、瑞典卡罗林斯卡学院和加拿大渥太华大学等研究机构的研究人员一些肿瘤细胞在暴露于基因毒性治疗后能够启动一种促进DNA链断裂的caspase活化脱氧核糖核酸酶(caspase-activated DNAse, CAD)。相关研究结果发表在2022年4月29日的Science期刊上,论文标题为“Cancer cells use self-inflicted DNA breaks to evade growth limits imposed by genotoxic stress”。在这篇论文中,他们指出断裂的DNA链有助于肿瘤通过防止自身细胞死亡来克服治疗。
图片来自Pixabay/CC0 Public Domain。
先前的研究已表明,向癌性肿瘤发射一束辐射可以杀死组成肿瘤的细胞,但是很多时候,一些癌细胞在攻击中幸存下来,使肿瘤再次开始生长。先前的研究还表明,非癌细胞在受到辐射时通常会激活G1细胞周期检查点作为一种自我保护的手段,但是这种机制对癌细胞不起作用。这让科学家们想知道一些肿瘤细胞是如何在这种治疗后生存下来的。
在这项新的研究中,这些作者在利用骨癌细胞进行筛选工作时注意到,CAD似乎在防止肿瘤细胞死亡方面发挥了作用。在向肿瘤细胞样本发射辐射后,他们发现了他们所描述的DNA链上的“神秘缺口”,这些缺口是在发射辐射约12至18小时后出现的。在猜测CAD可能是造成这些缺口的因子后,他们在一些肿瘤细胞样本中让这种酶失活,这些肿瘤细胞对辐射变得更加敏感,它们也倾向于比正常情况下提前进入有丝分裂。接下来,他们将人类肿瘤细胞移植到小鼠体内,并测试了加入CAD的影响。这导致了这些肿瘤细胞能够更好地承受辐射治疗。
2.Science:首次鉴定出传递愉快触觉的神经回路和神经肽
doi:10.1126/science.abn2479
在一项新的研究中,来自美国华盛顿大学圣路易斯医学院和中国中医科学院针灸研究所的研究人员通过研究小鼠,发现了一种神经回路和一种在神经元之间传递信号的称为神经肽的化学信使,从而将称为愉快触摸(pleasant touch)的感觉从皮肤传递到大脑。相关研究结果发表在2022年4月29日的Science期刊上,论文标题为“Molecular and neural basis of pleasant touch sensation”。
论文通讯作者、华盛顿大学圣路易斯医学院瘙痒与感觉障碍研究中心主任Zhou-Feng Chen博士及其团队发现,当他们培育出没有这种称为prokinecticin 2(PROK2)的神经肽的小鼠时,这些小鼠不能感觉到愉快的触摸信号,但继续对瘙痒和其他刺激作出正常反应。
在其他发现中,Chen团队发现,经改造后成缺乏PROK2或者缺乏表达它的受体的脊髓神经回路(PROKR2)的小鼠也避免梳理毛发等活动,并表现出正常小鼠所没有的压力迹象。他们还发现,与成年后愉快触摸反应被阻断的小鼠相比,从出生起就缺乏愉快触觉的小鼠有更严重的压力反应,并表现出更大的社会回避行为。Chen说,这一发现强调了母体触摸在后代发展中的重要性。
3.Science:挑战常规!细胞基因组中的一些DNA环并不长期持续存在
doi:10.1126/science.abn6583
在人类染色体中,DNA被蛋白包裹,形成一条超长的串珠线。这条串珠线经折叠后形成许多环(loop),据信这些环有助于细胞控制基因表达和促进DNA修复,以及其他功能。在一项新的研究中,来自麻省理工学院、马克斯-普朗克分子细胞生物学与遗传学研究所的研究人员发现,这些环是非常动态的,而且比以前认为的寿命更短。相关研究结果发表在2022年4月15日的Science期刊上,论文标题为“Sphingolipids control dermal fibroblast heterogeneity”。
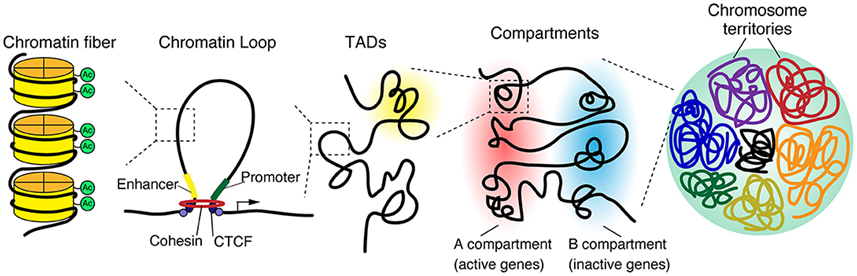
三维基因组结构,图片来自Frontiers in Cell and Developmental Biology, 2021, doi:10.3389/fcell.2020.626541。
在这项新的研究中,这些作者能够在大约两个小时的时间里监测活细胞中的一段基因组---Fbn2拓扑关联结构域(topologically associating domain, TAD)---的运动。他们观察到这段基因组只有3%到6%的时间是完全成环的(即形成环状结构),所形成的环只持续了大约10到30分钟。这些发现表明科学家们目前对DNA环如何影响基因表达的理解可能需要修正。
这些作者用他们的方法对小鼠胚胎干细胞中的一段基因组进行成像。论文共同第一作者、麻省理工学院研究生Simon Grosse-Holz说,“如果我们把我们的数据放在一个持续约12小时的细胞分裂周期的背景下,完全形成的DNA环实际上只存在约20至45分钟,仅占约3%至6%的时间。”
4.Science:在迄今最大规模的全基因组测序数据中鉴定替换突变特征
doi:10.1126/science.abl9283
突变特征(mutational signature,也译为突变信号、突变标记或突变签名)---在肿瘤发生过程中起作用的DNA损伤和修复过程的印记---使人们了解每名患者所患癌症的环境原因和内源性原因。癌症基因组测序研究允许对突变特征进行探索。在一项新的研究中,来自英国剑桥大学的研究人员调查了多种肿瘤类型的大量经过全基因组测序的癌症,比以前的研究多得多,以便全面加强他们对突变特征的理解。相关研究结果发表在2022年4月22的Science期刊上,论文标题为“Substitution mutational signatures in whole-genome–sequenced cancers in the UK population”。
这些作者对通过英国国家卫生服务系统(NHS)为十万人基因组计划(100,000 Genomes Project)前瞻性地收集的12222例经过全基因组测序的癌症进行突变特征分析。他们在每个器官中独立鉴定了单碱基替换(SBS)和双碱基替换(DBS)突变特征。利用这个特别庞大的队列,他们开发了一种方法来加强对常见突变过程和罕见的、低频率的突变过程的区分。
这些作者通过对两个公开的队列的数据---国际癌症基因组联盟(International Cancer Genome Consortium, ICGC)的3001例原发性癌症和哈特维希医学基金会(Hartwig Medical Foundation)的3417例转移性癌症---进行独立分析来验证他们的发现。他们通过比较和对比独立得出的组织特异性突变特征,并进行聚类分析,将来自不同组织的可能由类似过程引起的突变特征联合起来,从而产生了一组参考突变特征(reference signature)。
5.Science:揭示一些中和抗体仍可有效中和包括奥密克戎在内的新冠病毒变体
doi:10.1126/science.abn8897
作为令人关注的SARS-CoV-2变体,B.1.1.529(Omicron,奥密克戎)的出现和快速传播引起了人们的警惕。特别麻烦的是Omicron受体结合结构域(RBD)中的15个氨基酸替换,因为靶向RBD的抗体(即RBD靶向抗体)是唯一被发现对其他变体保持足够效力的抗体。为了确定能有效中和Omicron的抗体,来自美国国家过敏与传染病研究所的研究人员在一项新的研究中评估了RBD靶向抗体结合和中和Omicron的能力,并利用功能试验和低温电镜(cryo-EM)结构确定了它们的识别模式。相关研究结果发表在2022年4月22的Science期刊上,论文标题为“Structural basis for potent antibody neutralization of SARS-CoV-2 variants including B.1.1.529”。
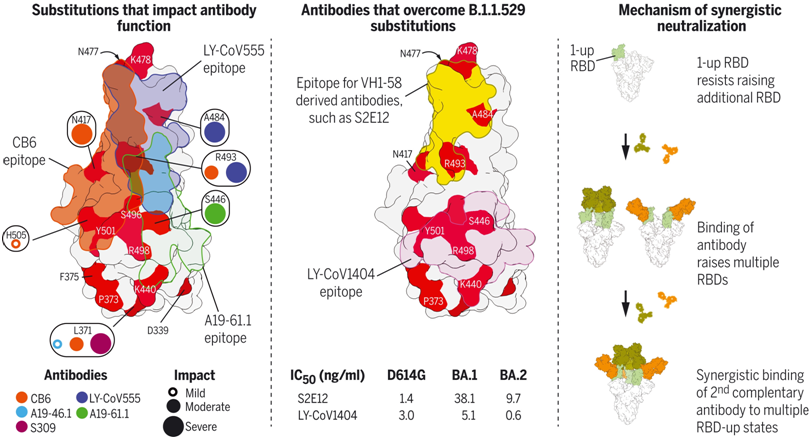
单克隆抗体及其组合有效中和B.1.1.529的结构基础。图片来自Science, 2022, doi:10.1126/science.abn8897。
对于与受体ACE2竞争结合的I类和II类抗体,比如VH1-58衍生性的抗体B1-182.1和S2E12,这些分析显示有效的中和需要较小的抗体侧链以适应S477N突变。对于其他抗体,比如LY-CoV555和A19-46.1,这些抗体的表位相邻于多个RBD氨基酸替换。E484A或Q493R大大降低了LY-CoV555的结合,然而对于A19-46.1来说,这些替换通常是可以容忍的,A19-46.1与刺突蛋白的低温电镜结构显示了两个RBD向上构象,A19-46.1只与向上构象的RBD结合。对于在ACE2结合表面之外结合的III类和IV类抗体---比如A19-61.1、COV2-2130、S309和LY-CoV1404---来说,个别的RBD氨基酸替换一般都是可以容忍的。
然而,A19-61.1的中和作用被G446S消除了;COV2-2130显示对Omicron的中和作用大大降低,但没有一个突变表现出实质性影响;S309保留了对Omicron的效力,尽管对Omicron的BA.2亚型的效力不大(半最大抑制浓度降至1374 ng/ml);LY-CoV1404保留了有效的中和作用(对BA.1和BA.2亚型分别为5.1和0.6 ng/ml)。
最后,这些作者评估了单克隆抗体的组合,发现有几个组合,包括B1-182.1和A19-46.1的组合,显示出中和的协同作用。Omicron刺突蛋白与B1-182.1和A19-46.1的三元复合物的结构表明,B1-182.1诱导首选的向上RBD结合构象以促进A19-46.1的协同结合,这是它们协同作用的基础。
6.Science:组织细胞分裂促进巨噬细胞渗透到组织中
doi:10.1126/science.abj0425
为了到达需要免疫细胞的地方,这些细胞不仅要挤过微小的孔隙。它们甚至能克服由密集的细胞构成的像墙一样的障碍。在一项新的研究中,来自奥地利科学技术研究所的研究人员发现细胞分裂是它们成功的关键。他们的研究结果与近期的其他研究结果一起,全面阐述了对组织损伤愈合和癌症扩散同样重要的过程。相关研究结果发表在2022年4月22日的Science期刊上,论文标题为“Cell division in tissues enables macrophage infiltration”。
在果蝇的发育过程中,巨噬细胞---果蝇中最主要的免疫细胞形式---会渗透到组织中。利用高端显微镜,论文共同通讯作者、奥地利科学技术研究所的Daria Siekhaus教授及其团队能够跟踪它们的旅程。论文第一作者兼论文共同通讯作者、Siekhaus团队博士后研究员Maria Akhmanova解释说,“巨噬细胞到达像墙一样的障碍并寻找合适的地方进入。”
7.Science:重大进展!在人类中首次发现KIR+CD8+T细胞抑制致病性T细胞,有望开发出治疗自身免疫性疾病和传染性疾病的新方法
doi:10.1126/science.abi9591
之前的研究已确定Ly49+CD8+T细胞是小鼠中具有调节功能的CD8+T细胞亚群。这些细胞可以通过它们的细胞溶解活性抑制髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein, MOG)特异性的致病性CD4+T细胞,从而改善实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)。然而,在人类中是否存在类似的CD8+调节性T细胞亚群,以及它们的抑制活性是否超出了自身免疫性疾病的范围而在外周耐受(peripheral tolerance)中发挥更普遍的作用,这些都有待确定。
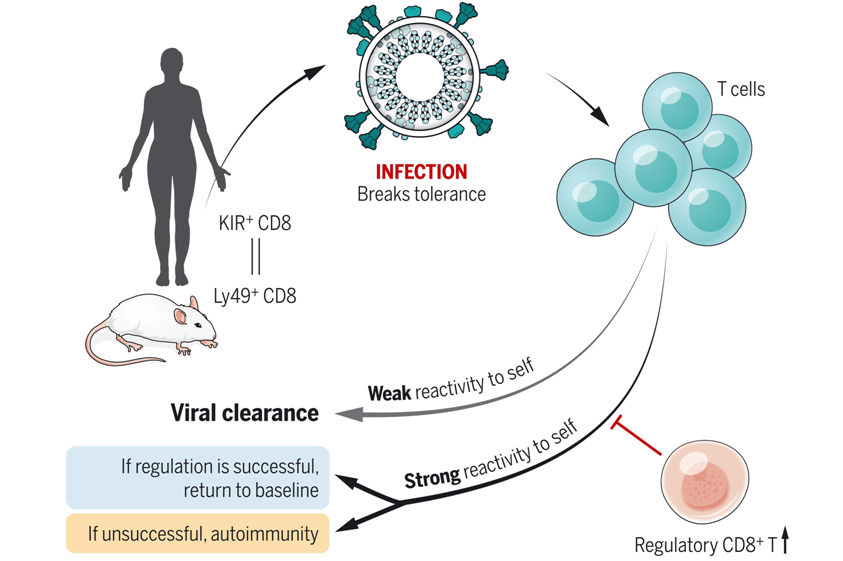
CD8+调节性T细胞在外周耐受中的作用。图片来自Science, 2022, doi:10.1126/science.abi9591。
鉴于KIR(killer cell immunoglobulin-like receptor)受体是小鼠Ly49蛋白家族在人类进化中的对应物,来自斯坦福大学等研究机构的研究人员研究了KIR+CD8+T细胞是否是小鼠Ly49+CD8+T细胞的表型和功能对应物。他们评估了人类自身免疫性疾病和传染性疾病中KIR+CD8+T细胞的频率,并分析了它们的转录图谱以及T细胞受体(TCR)库。相关研究结果发表在2022年4月15日的Science期刊上,论文标题为“KIR+CD8+ T cells suppress pathogenic T cells and are active in autoimmune diseases and COVID-19”。
8.Science:科学家成功解码肠道菌群和大脑之间的直接对话奥秘
doi:10.1126/science.abj3986
肠道微生物的副产物能在血液中循环并调节宿主机体的多种生理学过程,包括免疫力、代谢和大脑功能等。近日,一篇发表在国际杂志Science上题为“Bacterial sensing via neuronal Nod2 regulates appetite and body temperature”的研究报告中,来自法国巴斯德研究所等机构的科学家们通过研究发现,动物模型机体中的下丘脑神经元或能直接检测细菌活性的改变,并相应地调整机体的食欲和温度,这些研究结果表明,肠道微生物和大脑之间或许会发生一种直接的对话,而这一研究发现或许有望帮助开发新型治疗性策略来解决诸如肥胖和糖尿病等多种人类代谢性疾病。
肠道时人类机体中最大的细菌存储库,如今越来越多的研究证据揭示了宿主和肠道微生物之间的相互依赖程度,并强调了脑-肠轴的重要性;如今研究人员共享着他们的专业知识,并研究了肠道中的细菌是如何直接控制大脑中特定神经元的活性的。文章中,研究人员重点对NOD2(核苷酸寡聚结构域,nucleotide oligomerization domain)受体进行了研究,其主要存在于免疫细胞中,该受体能检测到胞壁肽(muropeptides)的存在,胞壁肽是细菌细胞壁的重要组成部分,此外,此前研究人员已经确定,负责编码NOD2的基因的突变或许与机体的消化系统障碍有关,包括克罗恩病等,同时还与机体的神经系统疾病和情绪障碍有关;然而,这些研究数据并不足以阐明大脑中神经活性和肠道中细菌活性之间的直接关联,而这一点已经被目前科学家们所阐明了。
利用大脑成像技术,科学家们最初观察到,小鼠机体中的NOD2受体或许能被大脑中不同区域中的神经元所表达,尤其是在海马体区域中;随后研究人员发现,当与来自肠道中的细菌胞壁肽密切接触时,这些神经元电活性或许就会被抑制,研究者Ivo G. Boneca解释道,肠道、血液和大脑中的胞壁肽被认为是细菌增殖的标志物,相反,如果NOD2受体不存在的话,这些神经元的活性就不会被胞壁肽所抑制,因此,大脑就会失去对食物摄入和体温的控制,小鼠机体的体重就会增加,且更易于患上2型糖尿病,尤其是老年雌性小鼠。
9.Science:重大进展!选择性抑制mTORC1有望阻止非酒精性脂肪肝
doi:10.1126/science.abf8271
在一项新的研究中,来自宾夕法尼亚大学佩雷尔曼医学院等研究机构的研究人员假设,有选择地调节肝脏mTORC1信号传导可能有利于肝脏脂质代谢和预防NAFLD。在非肝脏细胞类型中,蛋白folliculin(FLCN)已被证实可赋予mTORC1的底物特异性。剔除FLCN可抑制mTORC1介导的转录因子E3/B(TFE3/B)家族的磷酸化,但不影响mTORC1驱动的其典型底物S6K1(S6 kinase beta-1)和真核生物翻译启动因子4E-BP1(4E–binding protein 1)的磷酸化。未磷酸化的TFE3转运到细胞核并激活促进溶酶体生物生成、线粒体生物生成和氧化代谢的基因。他们推断,抑制肝脏中的FLCN可能会促进脂肪酸氧化和脂质清除,而不会产生因mTORC1普遍抑制而出现的不良影响。相关研究结果发表在2022年4月15日的Science期刊上,论文标题为“Inhibition of nonalcoholic fatty liver disease in mice by selective inhibition of mTORC1”。

肝脏中Flcn缺失可通过选择性抑制mTORC1保护小鼠免受NAFLD和NASH的影响。高脂肪、碳水化合物和胆固醇的饮食会导致NAFLD和NASH。当Flcn同时被剔除时,mTORC1受到选择性抑制,保留了其典型底物S6K和4E-BP1的磷酸化,但阻断了转录因子TFE3的磷酸化。未磷酸化的TFE3被释放到细胞核,在那里它激活脂质分解代谢基因,同时抑制脂肪从头合成基因。图片来自Science, 2022, doi:10.1126/science.abf8271。
这些作者发现成年小鼠中肝细胞特异性的Flcn基因缺失可选择性地抑制mTORC1介导的TFE3细胞质隔离,而对其他mTORC1靶标---包括S6K、4E-BP1和Lipin1---影响不大。肝细胞缺乏Flcn保护小鼠免受NAFLD和NASH的影响,并部分逆转这些已经建立的过程。免受NAFLD和NASH的影响需要激活TFE3来清除脂质。激活的TFE3还能抑制脂质从头合成,而脂质从头合成部分上是由TFE3调节的Insig2(insulin-induced gene 2)基因激活以抑制蛋白SREBP-1c---一种关键的成脂性转录因子---的酶水解激活而介导的。
10.Science:重大进展!将大鼠多能性干细胞成功诱导为原始生殖细胞样细胞,并培育出健康的大鼠后代
doi:10.1126/science.abl4412
利用多能性干细胞(pluripotent stem cell, PSC)在体外产生生殖细胞,对未来的生殖医学和动物育种有很大的影响。在一项新的研究中,来自日本多个研究机构的研究人员成功地利用在体外产生的大鼠生殖细胞培育出大鼠后代。相关研究结果发表在2022年4月8日的Science期刊上,论文标题为“Functional primordial germ cell–like cells from pluripotent stem cells in rats”。在这篇论文中,他们描述了他们的方法,并解释了为什么他们认为他们的研究工作将导致对其他物种的体外配子发生的更好理解。
在2011年,2011年,已有一个研究团队开发出一种将小鼠多能性干细胞分化为能够进行配子发生的原始生殖细胞样细胞(primordial germ cell-like cell, PGCLC)的方法,从而在体外重建小鼠生殖细胞特化,更具体地说,开发出一种利用小鼠多能性干细胞产生小鼠精子样细胞(sperm-like cell)的方法,然后用这些精子样细胞使一只雌性小鼠受孕并生下健康的幼鼠。自那时起,已经有许多科学家试图在另一个物种中重复这一壮举,但是在此之前诱导PGCLC在体外产生配子还没有在任何其他物种中实现。这表明实现这一过程可能是多么困难。在这项新的研究中,这些作者以早前的研究为模板,在大鼠身上复制了这一过程。
该过程首先诱导大鼠胚胎干细胞产生胚胎中的上胚层样细胞(epiblast-like cell)。这些作者随后将产生的上胚层样细胞放在含有信号分子和其他成分的培养基中,促进它们转变为大鼠PGCLC。接下来,PGCLC与促进它们成熟和表观遗传重编程的性腺体细胞一起培养,这是模拟正常成熟过程的一种手段。一旦PGCLC成熟了,它们就被移植到一只经过改造后没有生殖细胞的雄性大鼠的睾丸生精小管中。他们让它们自然发育为成熟的精子。他们随后从这只雄性大鼠身上取出精子样本,并将它们直接注射到一只活的雌性大鼠的卵母细胞中,该雌性大鼠生下了健康的后代。他们指出,这些后代成长并能够自然繁殖。
11.Science:新研究鉴定出5504个新的海洋RNA病毒,将已知的RNA病毒门类的数量增加一倍
doi:10.1126/science.abm5847
在一项新的研究中,一个国际研究团队通过分析海洋中的遗传物质,鉴定出数千种以前未知的RNA病毒,并使被认为存在的病毒门类(phyla)的数量增加了一倍。相关研究结果发表在2022年4月8日的Science期刊上,论文标题为“Cryptic and abundant marine viruses at the evolutionary origins of Earth’s RNA virome”。
这些作者共确定了5504个新的海洋RNA病毒,并将已知的RNA病毒门类的数量从5个增加到10个。对这些新的序列进行地理绘图显示,其中的两个新门类在广阔的海洋区域特别丰富,对这些新的序列进行地理绘图显示,其中两个新的门类在广阔的海洋地区特别丰富,在温带和热带水域(Taraviricota,以Tara Oceans expeditions命名)或北冰洋(Arctiviricota)有区域偏好。
RNA病毒组(RNA virome),图片来自Frontiers In Microbiology, 2017, doi:10.3389/fmicb.2017.02097。
这些作者认为,Taraviricota可能是科学家们长期以来一直在寻找的RNA病毒进化中的缺失一环,它连接了RNA病毒的两个不同的已知分支,这两个分支在病毒复制方式上存在差异。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


