MUCOSAL IMMUNOL:组织信号标记ILC2s中Aiolos的表达以调节2型免疫
来源:生物谷 2021-09-02 23:54
第2组先天淋巴细胞(ILC2)是缺乏T和B细胞抗原特异性受体的ILC亚群,ILC2s在主转录因子GATA结合蛋白3(GATA3)的表达和功能性细胞因子的产生方面与CD4+ 2型T辅助细胞(Th2)相似。该研究对调节Aiolos表达的分子机制及其在组织ILC2中的功能进行了分析,并为疾病期间特异性靶向ILC2提供了潜在的见解。
第2组先天淋巴细胞(ILC2)是缺乏T和B细胞抗原特异性受体的ILC亚群,ILC2s在主转录因子GATA结合蛋白3(GATA3)的表达和功能性细胞因子的产生方面与CD4+2型T辅助细胞(Th2)相似。ILC2s和Th2细胞都通过分泌白细胞介素5(IL-5)和IL-13在驱除寄生虫和诱导过敏方面发挥重要作用,IL-5和IL-13介导多种作用,包括募集骨髓细胞、嗜酸性粒细胞成熟、平滑肌收缩和上皮细胞产生粘蛋白,然而,在稳态下的组织中,ILC2s被发现是2型细胞因子的主要来源,并且是疾病早期过敏反应的关键驱动因素。此外,ILC2s还被报道能通过产生双调蛋白(AREG)促进上皮再生并且具有抗肿瘤能力,因此,ILC2s不仅是传染病或过敏症的有希望的治疗靶点,而且是组织损伤和肿瘤的有希望的治疗靶点。
图片来源:https://doi.org/10.1038/s41385-021-00431-5
研究者分析了来自骨髓(BM)、胰腺、肺和大肠(LI)的生长刺激表达因子2(ST2+)ILC2s的转录组学和表观遗传特征,以及来自小肠(SI)的杀伤细胞凝集素样受体亚家族(GKLRG1+)ILC2s的特征,将半乳糖凝集素-1(Galectin-1)确定为肺/胰腺ILC2的特征以及将Aiolos确定为稳态下的肠道ILC2的特征。Aiolos属于Ikaros锌指家族转录因子,由各类免疫细胞表达,能与Ikaros形成同源或异源二聚体,或与其他非Ikaros锌指家族转录因子和表观遗传调节剂相互作用,通过其C2H2 Krüppel样锌指基序直接结合目标DNA来调节基因表达。Aiolos已被证明可以调节ILC亚群的功能,因此,该研究对调节Aiolos表达的分子机制及其在组织ILC2中的功能进行了分析,并为疾病期间特异性靶向ILC2提供了潜在的见解。
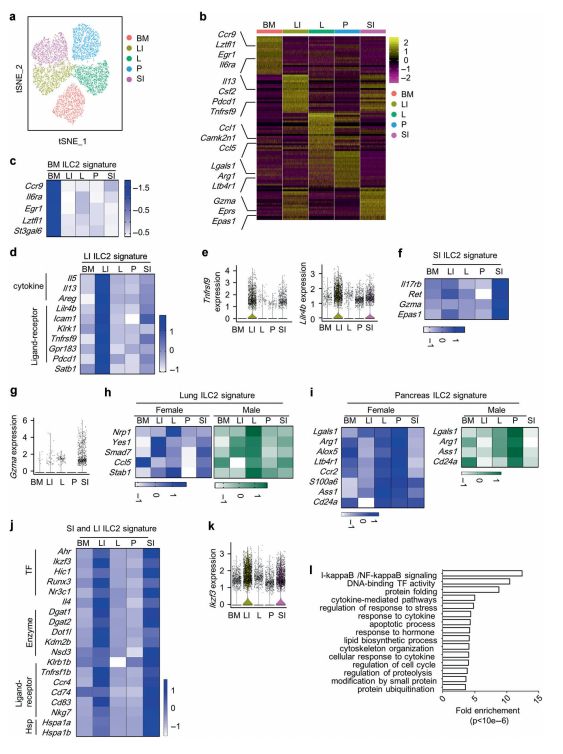

组织ILC2具有不同的特征 图片来源:https://doi.org/10.1038/s41385-021-00431-5
尽管在来自不同组织的ILC2s中发现了具有相似特征的子簇,但从每个组织中聚合下采样的ILC2s的分析显示出很强的异质性,研究者对组织ILC2之间的单细胞数据进行了成对比较,与所有其他四种组织ILC2相比,一个组织ILC2中通常上调的基因被指定为“ILC2组织特异性基因”(即ILC2TS基因)。以先前报道的ILC2组织特征作为对照,包括用于识别BM-ILC2的趋化性细胞因子受体9(Ccr9)、用于识别LI-ILC2的IL5和用于识别SI-ILC2的白介素17受体B(IL17rb),研究者识别并确认了ILC2s的几个组织特征,包括BM-ILC2s中的白介素6受体A(IL6ra)和亮氨酸拉链蛋白转录因子样1(Lztfl1)、LI-ILC2s中的肿瘤坏死因子受体超家族成员9(Tnfrsf9)和白细胞免疫球蛋白样受体4B(Lilr4b)、SI-ILC2s中的网织红细胞(Ret)、颗粒酶 A(Gzma)和内皮PAS结构域蛋白1(Epas1)、肺ILC2s的神经固蛋白1(Nrp1),以及胰腺ILC2s的重组人半乳糖凝集素1(Lgals1)、花生四烯酸-5-脂加氧酶(Alox5)和精氨酸酶(Arg1)。随后,研究者确认了基因的差异表达,与来自其他三种组织的ILC2s相比,LI和SI-ILC2s中的基因同时更高,而一系列基因被证实是肠道ILC2特征,包括肠道ILC2特征的芳烃受体(Ahr)和编码转录因子Aiolos的Ikzf3(即Aiolos基因)。
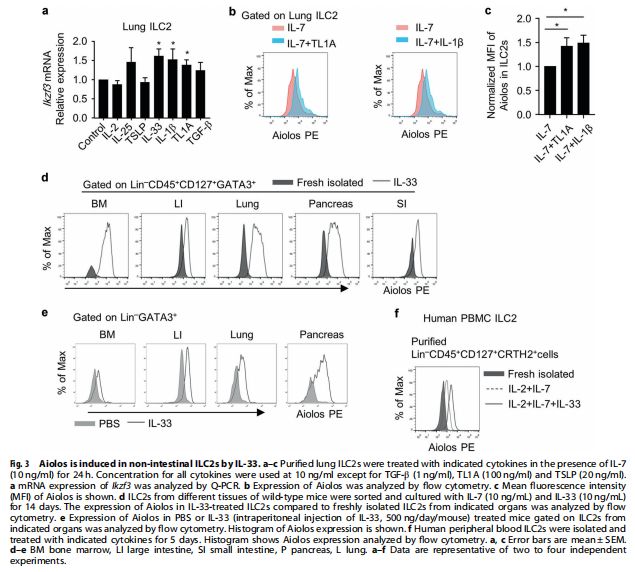
IL-33在非肠道ILC2中诱导Aiolos 图片来源:https://doi.org/10.1038/s41385-021-00431-5
该研究在一系列用于体外治疗ST2+ILC2s的细胞因子中寻找影响ILC2组织特征的潜在因素,发现IL-1β和肿瘤坏死因子配体相关分子1A(TL1A)在体外促进了肺ILC2中Aiolos的mRNA和蛋白质表达。此外,作为一种与全身过敏反应有关的细胞因子,IL-33在体外和体内促进了来自多个器官的ILC2中Aiolos的表达,同时,IL-33还在人外周血ILC2s中诱导了Aiolos表达,表明IL-33对Aiolos的保守调节。这些数据表明Aiolos可以通过促炎触发物(如IL-33)在非肠道器官中诱导,这反映了疾病期间ILC2组织特征的可塑性。
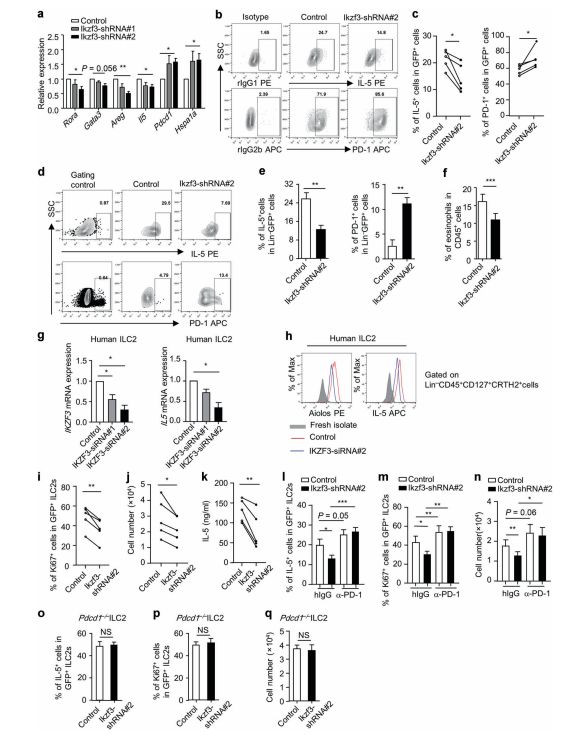

Aiolos通过抑制程序性死亡受体1(PD-1)来支持IL-5表达 图片来源:https://doi.org/10.1038/s41385-021-00431-5
研究者发现Ikzf3敲低会导致维甲酸受体相关孤儿受体A(Rora)、Gata3、Areg和IL5的mRNA表达降低,而PD-1细胞程序性死亡蛋白(Pdcd1)的mRNA表达增强,此外,与Ikzf3表达负相关的70KDa热休克蛋白1A(Hspa1a)的表达在Aiolos干扰后增加,然而,在蛋白水平上,Ikzf3-敲低ILC2s的GATA3表达没有改变,但IL-5的降低伴随着PD-1表达的增强是显著的。在体内转染Rag2–/–Il2rg–/–小鼠后,Aiolos表达减少的ILC2s表现出IL-5、AREG的表达降低和PD-1的增加并且ILC2s在将嗜酸性粒细胞募集到肠道中的功能因Aiolos缺陷而显著受损,而用小干扰RNA敲低IL-33处理的人ILC2s中的IKZF3导致Aiolos显著减少,同时伴随着IL-5在mRNA和蛋白质水平的降低,表明Aiolos对ILC2s中IL-5的表达具有物种保守性的调节作用。这些数据表明Aiolos通过抑制PD-1支持ILC2的维持和IL-5的产生。
该研究在转录组和表观基因组水平上分析了由组织微环境形成的组织ILC2异质性,虽然ILC2组织特征可能由一个或两个主要因素驱动,但支持和抑制信号的集合可能会协同调节ILC2 组织特征。除了抗体阻断和小鼠遗传工具外,配体和受体数据库还促进了对组织转录谱的全基因组筛选,这将有助于阐明赋予ILC2组织特征的因素,然而,难以由组织环境驱动的真正的ILC2组织特征的发现仍有待探索。 (生物谷 bioon)
参考文献
Jinxin Qiu et al. Tissue signals imprint Aiolos expression in ILC2s to modulate type 2 immunity. MUCOSAL IMMUNOLOGY(2021 Aug 04) doi:https://doi.org/10.1038/s41385-021-00431-5
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



