《自然·神经科学》:竟与多种中枢神经系统疾病有关,这种细胞什么来头?
来源:奇点糕 2022-08-19 18:05
阿尔茨海默病(AD),是最常见的一类神经退行性疾病。
阿尔茨海默病(AD),是最常见的一类神经退行性疾病。
很多人被老年痴呆这个名字给骗了,实际上,它并不是老年人的“专利”。当前,该病的发病率越来越高,也越来越趋于年轻化。
虽然目前针对AD还没有有效的治愈疗法,但是科学家一直致力于从不同方向来破解该病的致病机制,试图为其寻找有效的治疗靶点。
近日,来自以色列魏茨曼科学研究所的Ido Amit团队和Michal Schwartz团队合作,在《自然·神经科学》上发表重要研究成果[1]。
他们利用单细胞转录组学技术,研究了平常少有问津的少突胶质细胞群,在多种中枢神经系统疾病中均发现了一类“疾病相关的少突胶质细胞(DOLs)”,并鉴定出了DOLs的特征基因Serpina3n。
通过免疫共定位,他们发现Serpina3n阳性的少突胶质细胞分布在Aβ斑块富集的区域,这提示Serpina3n可能可以作为中枢神经系统疾病(如AD)的检测标志物,这也为多种中枢神经系统疾病的治疗提供了潜在的靶点。

论文首页截图
临床上,AD以记忆障碍、失语、失用、失认,以及人格和行为改变等全面性痴呆为特征。在病理上,它以淀粉样蛋白(Aβ)错误折叠,tau蛋白过度磷酸化,蛋白聚集体积累,形成淀粉样斑块、神经纤维缠结为特征[2]。由于人口老龄化和发病的趋于年轻化,AD已成为最主要的公共卫生挑战之一[3]。
一直以来,针对AD的研究一直以神经元为中心。在过去几十年的研究中,科学家才逐渐关注非神经元细胞,如脑内的先天免疫细胞(小胶质细胞)或者起营养支持作用的星型胶质细胞对疾病进展的潜在贡献[4,5]。相较之下,少突胶质细胞却鲜有人关注,它通常被认为是被动的旁观者,对外在的刺激反应有限。
实际上,少突胶质细胞是中枢神经系统重要的髓鞘形成细胞,它可包绕轴突,形成绝缘的髓鞘,协助生物电信号跳跃式高效传递,维持和保护神经元的正常功能。少突胶质细胞异常不仅会导致神经元脱髓鞘病变,还会引起神经元损伤或精神类疾病[6,7]。
而且,在AD和其他痴呆症的病人或小鼠模型的大脑中,科学家观察到大量的髓磷脂改变和分解[8]。不过,关于少突胶质细胞在AD病理中的命运是否会改变,如何改变,是否推动了AD或其它中枢神经系统疾病的病理进展?目前还少有研究。
为了回答这一系列问题,Amit团队和Schwartz团队借助单细胞RNA测序技术(MARS-seq2.0),对野生型和AD模型小鼠(5xFAD)全脑中的非神经元、非免疫细胞进行分离测序,并通过单细胞降维聚类分群工具,分析出17种细胞簇,其中占比最高的就是成熟的少突胶质细胞,以Plp1、Mbp和Mog为标志物。
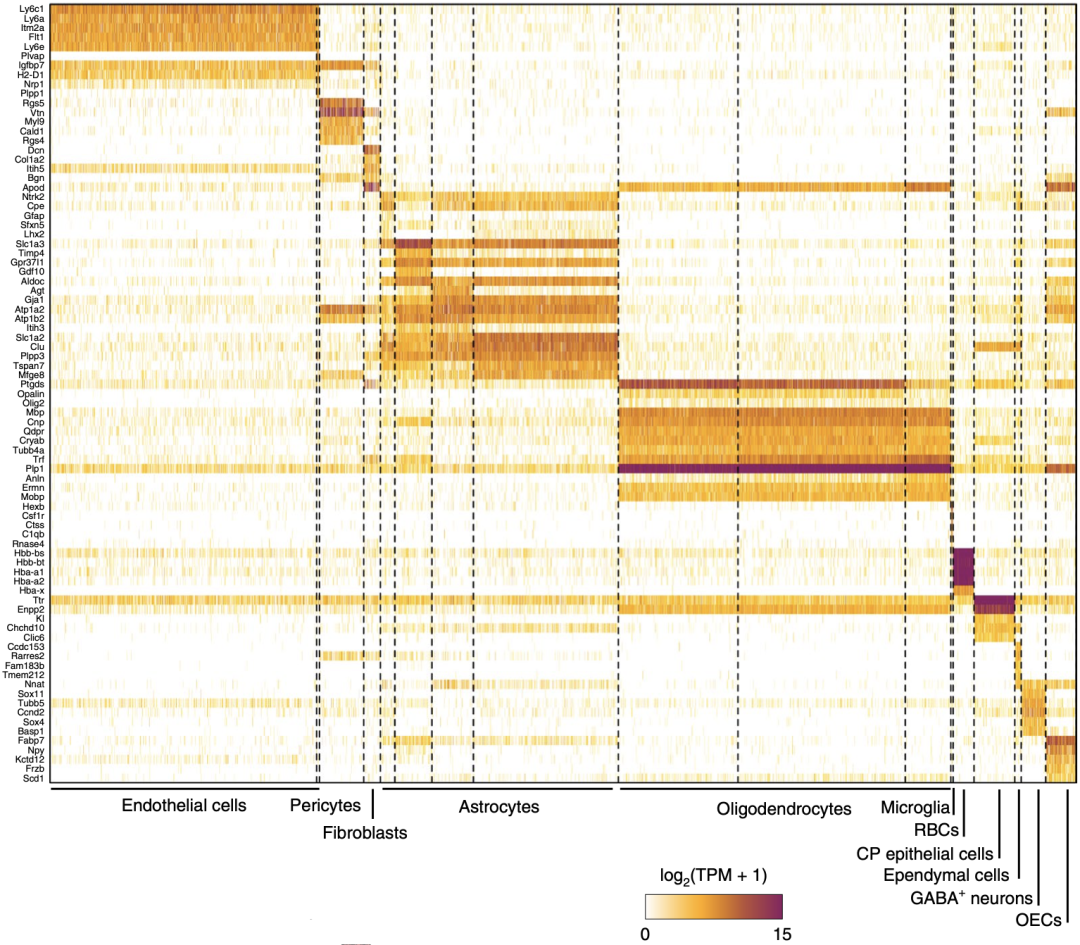
野生型与AD模型小鼠全脑中的非免疫细胞单细胞表达热图
进一步分析野生型小鼠和AD模型小鼠间差异表达的基因(DEGs),研究者发现少突胶质细胞具有最多的DEGs,而且在这些DEGs中,八成以上的基因仅表达于少突胶质细胞上,而不表达于其它任何类型的脑细胞,这说明少突胶质细胞在AD模型小鼠中表现出广泛且特异的转录变化。
为了进一步细化少突胶质细胞转录组的变化,研究人员利用髓鞘中富含的半乳糖神经酰胺,从小鼠脑中富集分选出半乳糖神经酰胺阳性的成熟少突胶质细胞。
给这些细胞做单细胞测序后,研究者鉴定出14种少突胶质细胞亚型。相比于野生型小鼠,其中第12类和第14类少突胶质细胞亚型在AD小鼠脑细胞中的比例显著上升,并随着AD病程的进展而持续增加。研究者称这类少突胶质细胞亚型为“疾病相关的少突胶质细胞”(DOLs)。
Amit团队和Schwartz团队进一步分析DOLs上差异表达的基因,鉴定出了26种异常高表达的基因,包括与免疫相关的基因,如Serpina3n、C4b、MHC-I、IL-33等,以及不与免疫相关的基因,如Klk6、Sgk1、CD9、CD63等。其中,与抑制丝氨酸蛋白酶相关的基因Serpina3n上调最为显著。
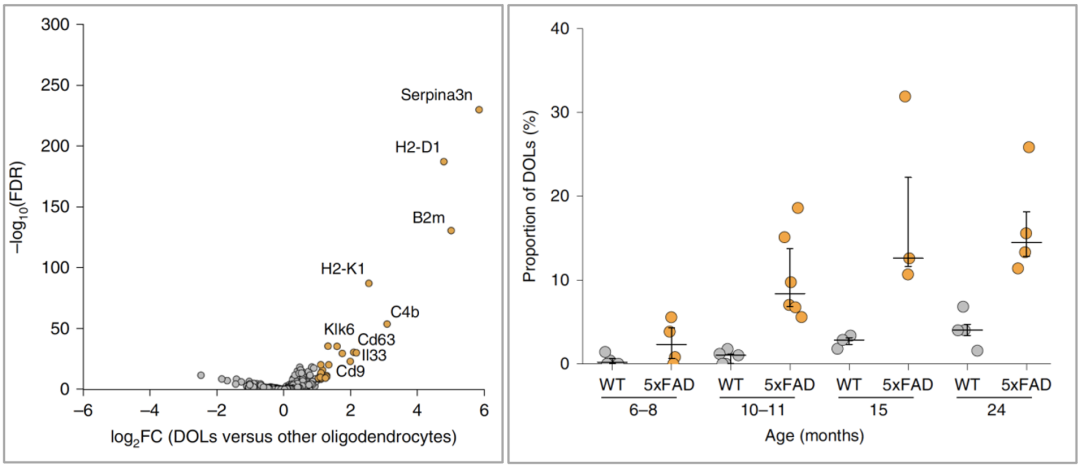
左图为DOLs上的差异表达基因;右图为DOLs在野生型和AD模型小鼠中的细胞占比
比较不同年龄段野生型和AD模型小鼠的少突胶质细胞群中DOLs的占比,研究人员发现DOLs的占比上调呈年龄依赖性。即在年龄越大的AD小鼠中,DOLs的占比越高。
这一点与“疾病相关的小胶质细胞”(DAM)非常不同,DAM通常在疾病早期(约1~2个月)就出现了,而DOLs的发生则需要在10个月之后,要晚于Aβ斑块和炎症的出现,这说明少突胶质细胞与小胶质细胞有着完全不同的应答周期。
既然DOLs的发生要晚于Aβ斑块,那么DOLs的产生是否独立于淀粉样病变呢?
为了回答这个问题,研究人员首先分析了另外两种非淀粉样病变引起的认知障碍的模型鼠,发现这两种模型鼠脑内均含有大量的DOLs,并且高表达DOLs的特征基因Serpina3n。
随后,研究人员直接用Aβ的寡聚体、纤维和斑块三种不同程度的聚合物处理原代少突胶质细胞,发现这三种Aβ聚合物均不能激活少突胶质细胞。
以上实验结果说明,Aβ并不能直接诱导DOLs的产生,或者说Aβ并不足够诱导DOLs的产生。

左图为DOLs在另两种AD模型鼠中的细胞占比;右图为Aβ处理后DOLs特征基因的log2FC值
既然DOLs的产生独立于淀粉样病变,那么DOLs是否也存在于其它中枢神经系统疾病中呢?
研究人员分析了脂多糖诱导的炎症模型和三种多发性硬化模型的单细胞测序数据集,发现这几种疾病模型中均富集表达DOLs特征基因,说明DOLs的产生是中枢神经系统疾病的共性。而且这些基因的表达水平随着病程进展而变化,即少突胶质细胞反应的强度与疾病严重程度正相关。
最后,研究人员通过对大脑切片做免疫共染,确定了AD模型鼠和AD病人DOLs的空间定位。
他们发现少突胶质细胞标志物Olig2和DOLs标志物Serpina3n双阳性的细胞与Aβ斑块之间存在空间相关性,相关性范围在30μm内。
虽然在Aβ斑块附近发现了DOLs,但是DOLs却在斑块积累很久之后才出现。再结合前面的实验结果,Aβ单独处理不足以诱发DOLs,而且在非淀粉样病变的模型中也发现了DOLs,这些都证明Aβ不足以触发这种细胞状态。然而,DOLs却出现在Aβ斑块富集的脑区,这提示了其他因素的参与,如损伤相关分子模式(DAMPs)、炎症、死细胞及各种代谢因子等,这些物质共同营造的“损伤微环境”会诱导DOLs的产生。
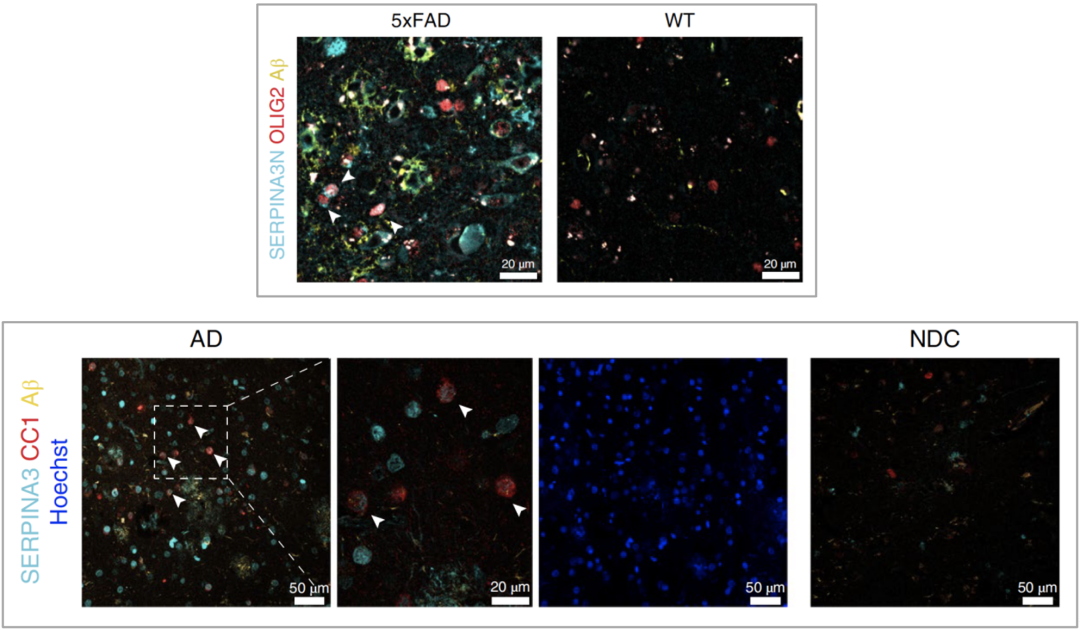
上图为AD模型鼠和野生型鼠脑片的免疫共染图;下图为AD病人和正常人脑片的免疫共染图
总的来说,Amit团队和Schwartz团队通过单细胞RNA测序技术,在阿尔茨海默病、多发性硬化、神经炎症等多种中枢神经系统疾病中均发现了一类“疾病相关的少突胶质细胞(DOLs)”。
通过进一步分析DOLs上差异表达的基因,他们鉴定出了DOLs的特征基因Serpina3n(该基因在人体内为Serpina3)。而且通过免疫共定位,他们发现Serpina3n阳性的少突胶质细胞分布在Aβ斑块富集的区域,这提示Serpina3n可能可以作为中枢神经系统疾病(如AD)的检测标志物,这也为多种中枢系统疾病的治疗提供了潜在的靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


