《肝病学杂志》:海军军医大学/复旦大学团队合力“揪出”导致肝癌对免疫治疗耐药的关键中性粒细胞亚群!
来源:奇点糕 2023-09-13 17:21
肝癌素来都以免疫微环境抑制性极强著称,这回抓到的CD10+ALPL+NEUs应该也为祸不浅,虽说研究团队表示,暂时还无法确定它们在免疫治疗耐药中的影响整体上有多重要,但发现一个是一个,先尽快针对这部分
近日,海军军医大学东方肝胆外科医院卫立辛、吴东团队与复旦大学周兆才、焦石团队合作,在Journal of Hepatology期刊发表的最新研究成果,就揪出了介导肝细胞癌(HCC)免疫治疗耐药的关键中性粒细胞亚群[1]。
研究显示,CD10和碱性磷酸酶(ALPL)表达均为阳性的中性粒细胞亚群(CD10+ALPL+NEUs),会在癌细胞外分泌的细胞因子——烟酰胺磷酸核糖转移酶(NAMPT)调控下始终处于未成熟状态,并表现出极强的免疫抑制能力,诱导CD8+T细胞进入不可逆的耗竭,从而使PD-1抑制剂治疗对肝癌难以见效。
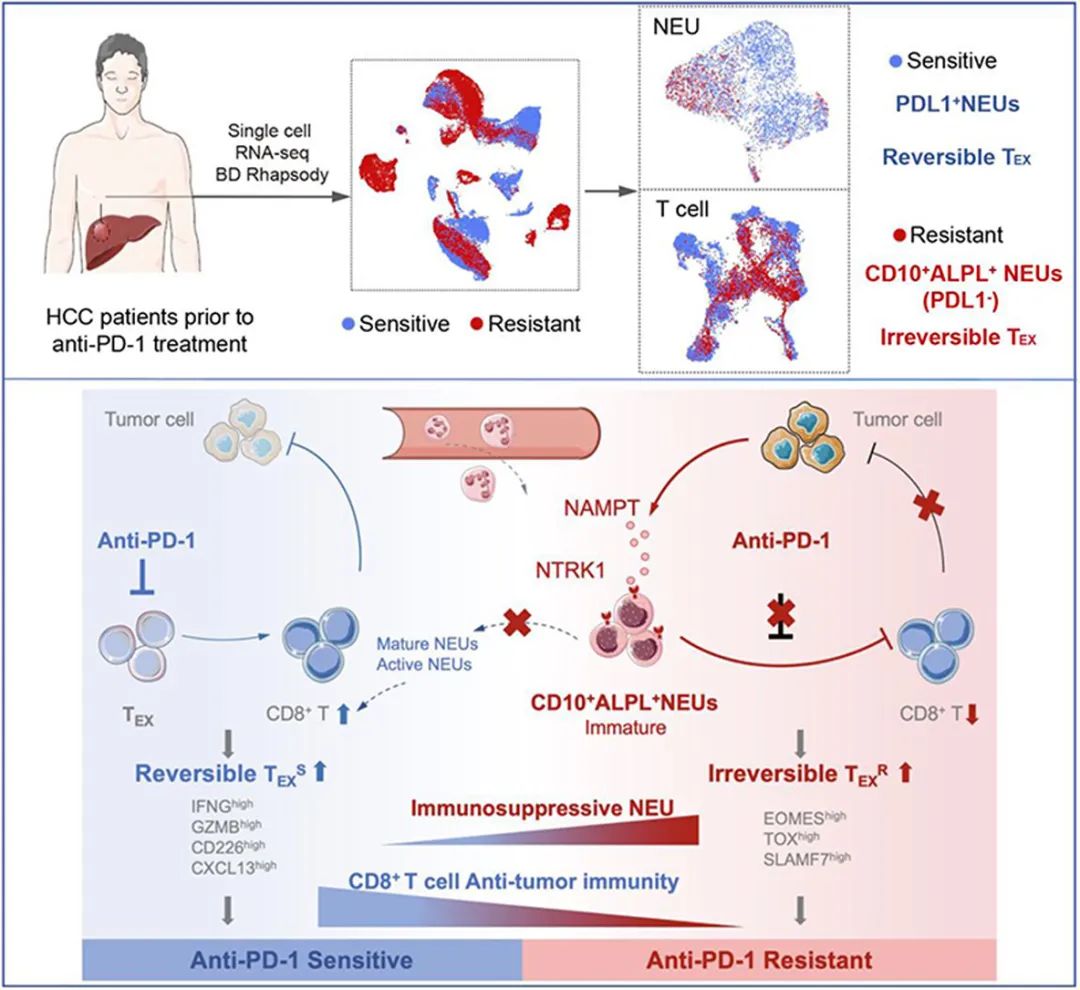
论文核心内容总结
对7例接受PD-1抑制剂治疗HCC患者的中性粒细胞进行单细胞测序时,研究者们初步锁定了可能与治疗耐药有关的亚群(NEU1),这部分中性粒细胞处于进化树早期、即整体呈未成熟状态,且CD10和ALPL表达阳性,而既往研究显示,ALPL可能与中性粒细胞的迁移、胞内活性氧生成和凋亡等功能有关[2]。
细分NEU1亚群时,只有CD10+ALPL+NEUs在PD-1抑制剂治疗开始前就已大量存在,且其数量基本不受免疫治疗的影响,因此研究者们将CD10+ALPL+NEUs专门分离出来,与CD8+T细胞进行共培养实验。
简简单单一个共培养,CD10+ALPL+NEUs就使能产生颗粒酶B、具有细胞毒性的CD8+T细胞数量锐减了40%,而呈现耗竭状态的CD8+T细胞(标志为PD-1阳性)则猛增了70%,这免疫抑制能力真够强的。将CD10+ALPL+NEUs过继性转移至小鼠体内,也会直接导致PD-1抑制剂的治疗耐药。
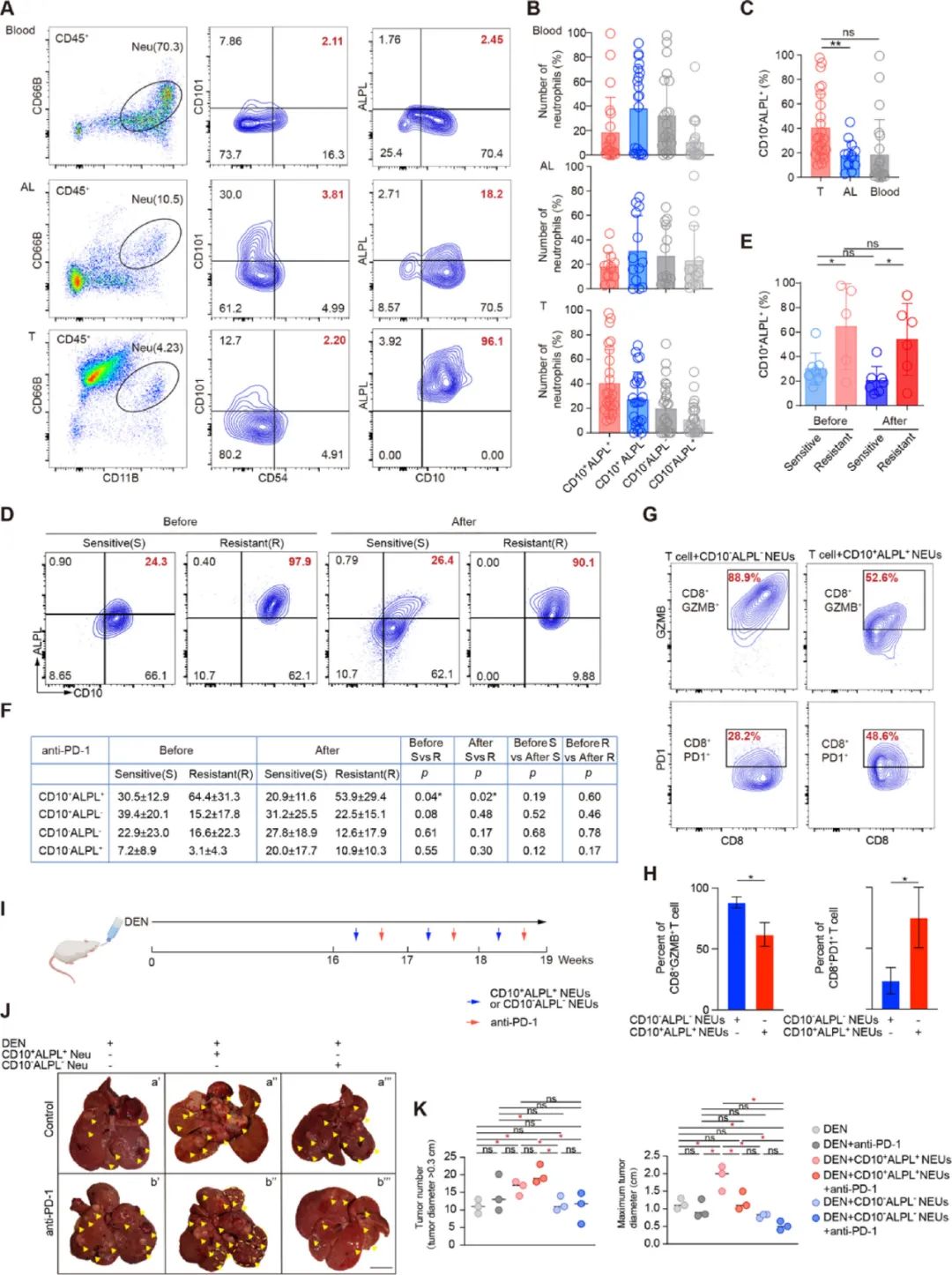
CD10+ALPL+NEUs的免疫抑制能力极强
研究者们又分析了HCC免疫治疗耐药患者体内的耗竭T细胞,发现这些T细胞会表达提示不可逆性耗竭的多种细胞因子,如EOMES、SLAMF7和TOX[3],即使是PD-1抑制剂也很难把它们救回来。CellPhoneDB单细胞互作分析也证实,CD10+ALPL+NEUs与耗竭T细胞间确实会发生受体/配体的“密切互动”。
不过这里奇点糕要给CD10+ALPL+NEUs小小正个名,它们并不是天生的“反社会人格”,在外周血中的占比极低(仅占总数的0.76%,肿瘤部位占比升至10.4%),免疫抑制功能也是在被募集到肿瘤部位、再被癌细胞带坏之后才产生的。
而在癌细胞带坏CD10+ALPL+NEUs的过程中,癌细胞外分泌的调节因子NAMPT必不可少,它会与CD10+ALPL+NEUs表面的受体NTRK1结合,对中性粒细胞发挥重编程作用,使它们长期处于不成熟且激活的状态,持续发挥免疫抑制作用。
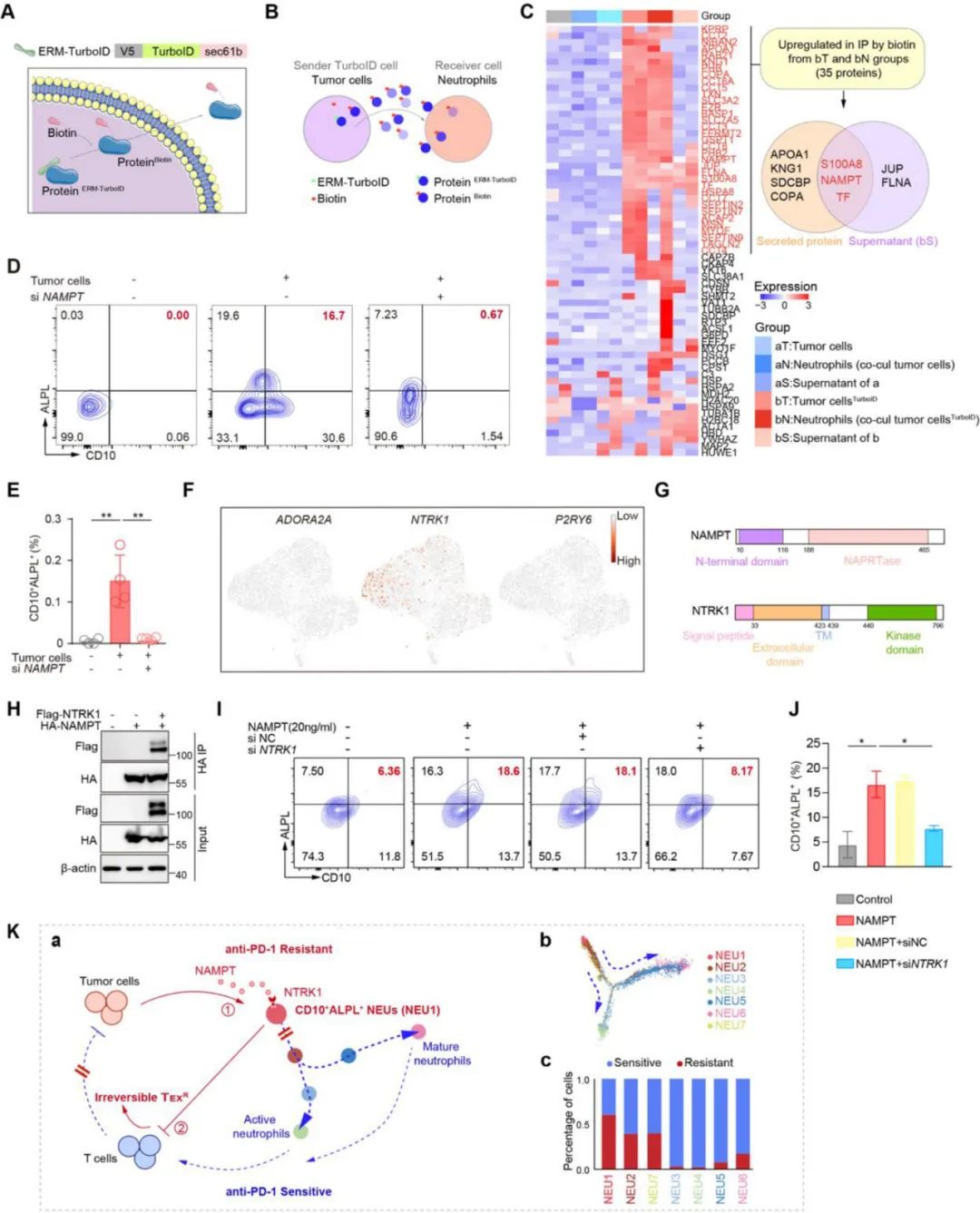
NAMPT-NTRK1信号轴的调控作用及研究整体机制总结
肝癌素来都以免疫微环境抑制性极强著称,这回抓到的CD10+ALPL+NEUs应该也为祸不浅,虽说研究团队表示,暂时还无法确定它们在免疫治疗耐药中的影响整体上有多重要,但发现一个是一个,先尽快针对这部分犯人开展精准打击吧。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


