JECCR:中山大学团队发现幽门螺旋杆菌诱导胃癌发生的新机制!
来源:奇点糕 2023-02-16 17:15
这项研究阐明了ac4C及其乙酰转移酶NAT10在胃癌中的作用,揭示了一种幽门螺旋杆菌促进胃癌发生的新机制,为幽门螺旋杆菌感染所导致的胃癌提供了一种新的治疗思路。
由于我国饮食结构复杂、幽门螺旋杆菌感染率较高,我国每年胃癌新发人数超40万例,发病率在所有肿瘤中排名第三[1]。目前手术联合化疗、免疫治疗及靶向治疗的进步极大地改善了胃癌患者的生存预后,但由于治疗效果存在较大异质性,仍有很多患者不能获益[2]。
因此,深入了解胃癌发病机制,鉴定新的治疗靶点,开发新型靶向治疗药物对于扩大治疗选择、延长胃癌患者生存、改善预后具有重要意义。
众所周知,幽门螺旋杆菌感染是胃癌的一大诱因,那么幽门螺旋杆菌是通过什么手段“作恶”的呢?
近日,由中山大学肿瘤中心陈永明和宋远斌教授领衔的研究团队在Journal of Experimental & Clinical Cancer Research发表了一项重要研究成果。这项研究发现,幽门螺旋杆菌通过诱导NAT10表达,导致泛素连接酶MDM2过表达并促进p53泛素化降解,从而促进胃癌发生[3]。
总之,这项研究揭示了幽门螺旋杆菌诱导胃癌发生的新机制,阐明了N4-乙酰胞苷(ac4C)修饰在胃癌发生中的作用。

文章封面截图
基因的调控在胃癌发生中占据了很重要的角色,其中以N6-甲基腺苷(m6A)、5-甲基胞苷(m5C)和N4-乙酰胞苷(ac4C)为主的mRNA转录后修饰近年来被认为与肿瘤发生密切相关,在靶向药物研发领域具有很高的潜力[4,5]。
在mRNA转录后修饰中,针对m6A及m5C都进行了大量研究,但对ac4C的认识还存在很大的不足。作为真核RNA唯一的乙酰化修饰[6],ac4C及其乙酰转移酶(NAT-10)在胃癌中的作用及机制仍然未知。
为探索mRNA修饰在胃癌中的功能和作用,陈永明团队通过液质联合质谱技术鉴定了20对胃癌组织和正常胃黏膜组织中的9种核苷酸修饰的水平,发现仅ac4C水平在胃癌组织中显著上调,其他类型的修饰水平无明显差异。此外,他们发现催化ac4C修饰的乙酰转移酶NAT10也在胃癌组织中特异性高表达(图1F),且高表达NAT10的患者生存预后更差(图1G)。
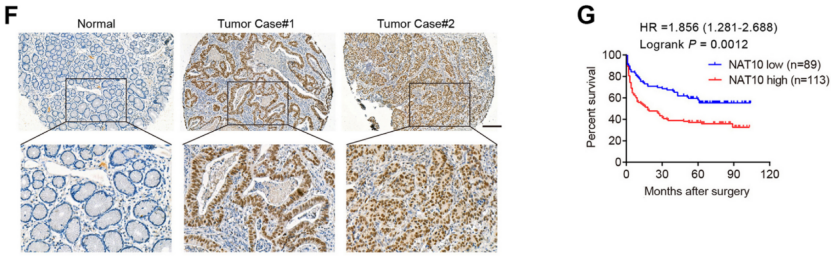
图1. NAT10在胃癌中的表达及与生存结局的相关性
为进一步明确NAT10及其介导的ac4C在胃癌发生中的作用,陈永明团队构建了NAT10敲除的胃癌细胞系,基于此构建了回补野生型NAT10、功能性乙酰转移酶结构域(G641E)或RNA解旋酶结构域(K290A)突变型NAT10的胃癌细胞系,并使用这些细胞系构建胃癌小鼠模型。
他们发现敲除NAT10可显著抑制小鼠肿瘤的生长及转移,回补野生型NAT10可逆转这种抑制效果,但回补K290A及G641E突变型的NAT10无逆转效果(图2),表明NAT10对胃癌的促进作用是依赖于其介导的ac4C修饰的。
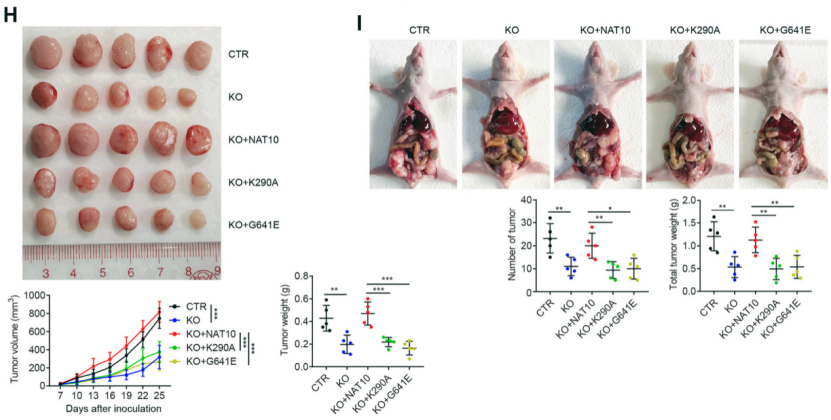
图2. NAT10及其介导的ac4C对胃癌生长及转移的作用
为明确NAT10促进胃癌的分子机制,陈永明团队对NAT10敲除前后的AGS细胞系进行了RNA-Seq和ac4C的免疫沉淀测序(acRIP-Seq)(图3A,B)。随后,他们对RNA-Seq和acRIP-Seq获得的差异求取了交集以筛选NAT10的下游基因,共计36个候选基因。
为进一步缩小范围,他们和另一株胃癌细胞系(BGC-823)的差异基因再次求取了交集,发现仅有MDM2符合筛选条件即NAT10敲除后MDM2的mRNA下调且ac4C乙酰化水平降低(图3C)。
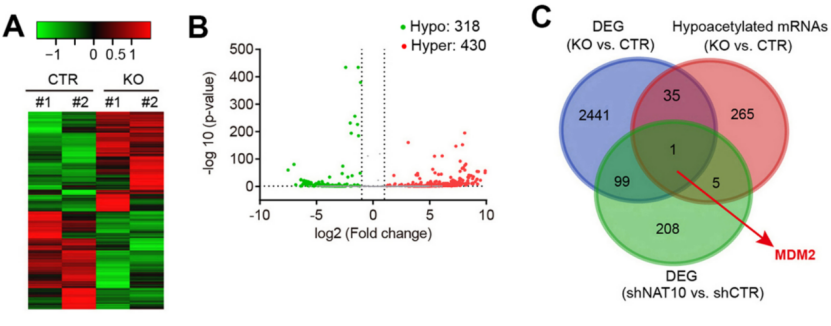
图3. NAT10下游特异性调控基因的筛选
陈永明团队发现,MDM2的mRNA在其3’UTR区被ac4C修饰,且NAT10敲除使得ac4C水平降低,并抑制MDM2的转录,而回补野生型NAT10可重新激活MDM2的转录,但回补K290A和G641E突变型NAT10却无法激活MDM2的转录(图4),表明NAT10介导的ac4C修饰介导了MDM2的转录激活。
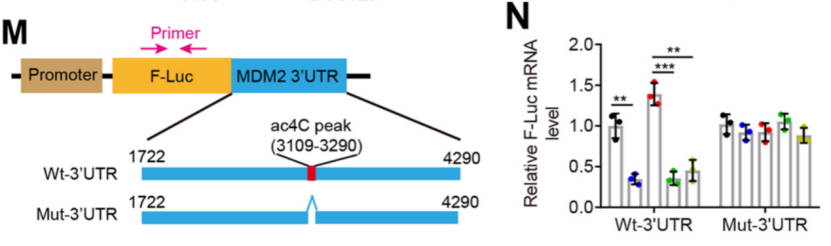
图4. 双荧光素酶报告基因实验检测NAT10对MDM2的转录激活作用
由于MDM2是介导肿瘤抑制因子p53泛素化降解的泛素连接酶,所以他们假设NAT10可通过ac4C修饰激活MDM2转录,诱导p53泛素化降解,从而促进胃癌发生。经验证,NAT10敲除后p53的蛋白水平显著升高,但mRNA水平无明显差异,且通过放线菌酮干预实验发现NAT10可加速p53蛋白的降解速率。
陈永明团队发现敲除NAT10对p53的上调作用可被MDM2过表达逆转,NAT10敲除可抑制胃癌生长,而在此基础上过表达MDM2可抵消这种抑制作用。此外,他们使用临床样本评估了NAT10和MDM2表达的相关性,发现NAT10和MDM2的表达在临床样本中呈现为正相关(图5G),且NAT10和MDM2都高表达的患者的生存预后更差(图5H)。
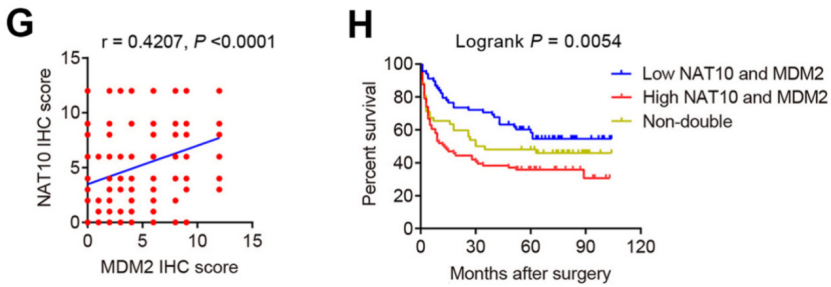
图5. NAT10和MDM2的相关性及与生存的相关性
有研究表明,幽门螺旋杆菌(Hp)感染可促进胃上皮细胞中p53的蛋白酶体降解[7],据此,陈永明团队猜测,Hp很有可能通过诱导NAT10的表达促进MDM2对p53的泛素化降解。经验证,Hp菌株SS1和ATCC43504与胃上皮细胞GES-1或胃癌细胞系AGS共培养后,NAT10和MDM2的表达显著上调,p53的表达显著下降(图6),表明Hp感染可能通过诱导NAT10表达、促进MDM2转录激活及p53泛素化降解,从而促进胃癌发生。
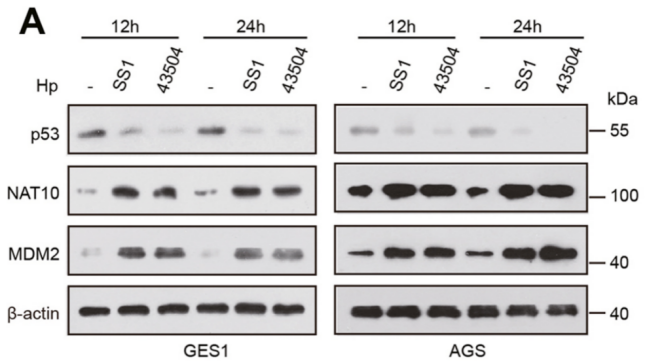
图6. Hp共培养后胃上皮细胞和胃癌细胞中NAT10、MDM2和p53表达的变化
考虑到NAT10和MDM2在胃癌发生中的重要作用,陈永明团队使用NAT10抑制剂Remodelin和MDM2抑制剂HDM201对胃癌荷瘤小鼠模型进行治疗。结果表明,HDM201和Remodelin单独治疗均可显著抑制小鼠肿瘤的生长并改善其生存,两者联合后可进一步增强肿瘤抑制和生存改善效果(图7)。
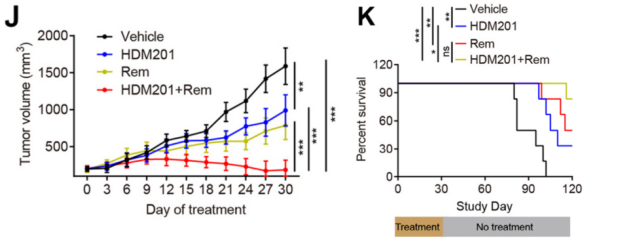
图7. NAT10和MDM2抑制剂对胃癌小鼠的治疗效果
综上所述,这项研究阐明了ac4C及其乙酰转移酶NAT10在胃癌中的作用,揭示了一种幽门螺旋杆菌促进胃癌发生的新机制,为幽门螺旋杆菌感染所导致的胃癌提供了一种新的治疗思路。
参考文献:
[1] Gastric Cancer Association CA-CA. Chinese expert consensus on perioperative treatment of locally advanced gastric cancer (2021 version). Zhonghua Wei Chang Wai Ke Za Zhi. 2021;24:741–8.
[2] Smyth EC, Nilsson M, Grabsch HI, et al. Gastric cancer. Lancet. 2020;396:635–48.
[3] Deng M, Zhang L, Zheng W, et al. Helicobacter pylori-induced NAT10 stabilizes MDM2 mRNA via RNA acetylation to facilitate gastric cancer progression. J Exp Clin Cancer Res. 2023 Jan 6;42(1):9. doi: 10.1186/s13046-022-02586-w.
[4] He L, Li H, Wu A, et al. Functions of N6-methyladenosine and its role in cancer. Mol Cancer. 2019 Dec 4;18(1):176. doi: 10.1186/s12943-019-1109-9.
[5] Wang T, Kong S, Tao M, et al. The potential role of RNA N6-methyladenosine in Cancer progression. Mol Cancer. 2020 May 12;19(1):88. doi: 10.1186/s12943-020-01204-7.
[6] Ito S, Horikawa S, Suzuki T, et al. Human NAT10 is an ATP-dependent RNA acetyltransferase responsible for N4-acetylcytidine formation in 18 S ribosomal RNA (rRNA). J Biol Chem. 2014 Dec 26;289(52):35724-30. doi: 10.1074/jbc.C114.602698.
[7] Wei J, Nagy TA, Vilgelm A, et al. Regulation of p53 tumor suppressor by Helicobacter pylori in gastric epithelial cells. Gastroenterology. 2010 Oct;139(4):1333-43. doi: 10.1053/j.gastro.2010.06.018.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


