盘点:2022年终盘点:肠道微生物组重磅级研究成果解读
来源:生物谷原创 2022-12-27 14:08
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在肠道微生物组研究领域取得了多项重要研究成果
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在肠道微生物组研究领域取得了多项重要研究成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理,分享给大家!
【1】Nat Metabol:肠道微生物组在塑造机体血液代谢组上扮演着特殊的角色
Christian Diener,Chengzhen L Dai,Tomasz Wilmanski, et al. Genome–microbiome interplay provides insight into the determinants of the human blood metabolome,Nature Metabolism (2022). doi:10.1038/s42255-022-00670-1
血液代谢组的变化与人类机体健康密切相关,然而,关于遗传学和微生物组之间的相互作用在逐个代谢产物的层面上解释这种变化的细节,研究人员却知之甚少。近日,一篇发表在国际杂志Nature Metabolism上题为“Genome–microbiome interplay provides insight into the determinants of the human blood metabolome”的研究报告中,来自美国系统生物学研究所等机构的科学家们通过研究揭示了与机体肠道微生物组、遗传学或两者之间发生相互作用的特殊血液代谢产物,相关研究结果或有望帮助指导科学家们开发靶向性疗法来改变机体血液代谢组的组成,从而改善人类健康。
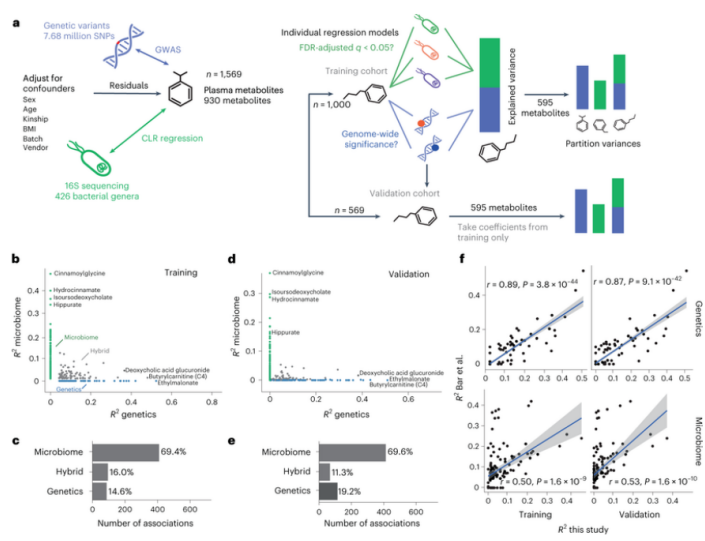
图片来源:Nature Metabolism (2022). doi:10.1038/s42255-022-00670-1
谚语“人如其食”(you are what you eat)有着近两百年的历史,如今关于这一谚语又有了新的证据,研究人员发现,肠道微生物组(包括我们喂养它们的东西)在很大程度上对不同人群机体循环的血液代谢产物的变化负责,这或许就能帮助我们设计靶向性的干预策略来改变人类血液代谢组的组成。研究者Sean Gibbons博士说道,我们知道,血液代谢组是机体血液中能与所有系统相互作用的小分子群,其在不同个体之间的差异或许会告诉我们关于机体健康和疾病状态的相关信息,而阐明指导这一变化背后的机制或许有望帮助研究人员开发改善人类健康的精准化策略。
文章中,研究人员对来自1500多名个体机体中的930种血液代谢产物进行分析,结果发现,有超过60%检测到的代谢产物都与宿主机体遗传特性或肠道微生物组之间存在明显关联;值得注意的是,69%的关联性都完全是由微生物组所驱动的,而15%的是由遗传特性驱动,16%受到了遗传学-微生物组的混合控制。研究者发现,由微生物组所解释的血液代谢产物的变化在很大程度上独立于由基因组所解释的变化,即使与遗传学和微生物都有显著关联的混合代谢产物,此外,某些代谢产物-微生物的关联性仅在拥有特定遗传背景的个体中较为显著,这或许就表明,微生物组和宿主遗传特性在塑造机体血液代谢组方面存在着非常细微的相互作用。综上,本文研究结果或有望帮助指导科学家们开发靶向性干预措施来改变人类机体血液代谢组的组成。
【2】Cancer Cell:肿瘤微生物组的相互作用或能帮助识别胰腺癌新型疗法
Bassel Ghaddar,Antara Biswas,Chris Harris,et al. Tumor microbiome links cellular programs and immunity in pancreatic cancer,Cancer Cell (2022). doi:10.1016/j.ccell.2022.09.009
在多种癌症类型中都能检测到微生物,包括在假定的无菌器官中,但其如何影响致癌机制以及人类机体中的抗肿瘤反应,目前研究人员并不清楚。近日,一篇发表在国际杂志Cancer Cell上题为“Tumor microbiome links cellular programs and immunity in pancreatic cancer”的研究报告中,来自美国罗格斯大学等机构的科学家们通过研究分析了胰腺肿瘤的微生物组特征,并在单细胞分辨率下识别出了特定的微生物或与机体炎症和患者生存率有关。
研究者Subhajyoti De说道,这项研究中,我们开始深入研究是否胰腺肿瘤中会定植某些微生物,以及是否其会影响癌症的进展和疗法的治疗,然而,研究肿瘤中的微生物非常困难,部分原因是每名患者都不一样,而且因为微生物的足迹非常细微,通常无法对其进行可靠地检测。
为了进一步研究,研究人员通力合作开发出了一种名为SAHMI(宿主-微生物组互作单细胞分析,Single-cell analysis of Host-Microbiome Interactions)的基因组方法来识别与单一人类细胞相关的微生物,利用复杂的软件对数百万条RNA序列进行筛选,研究人员就能识别出哪些可能会代表人类的基因,以及哪些是源自微生物的基因。研究者De说道,这种新技术就能促进我们识别出与肿瘤相关的微生物,并同时测定宿主细胞的活性,这或许就是一项重大的技术进步,其结果令人惊叹。
研究者Blaser说道,我们的观察提供了一种观点解释了为何胰腺癌难以治疗,通过后期更深入地理解这些相互作用或许就能帮助识别治疗胰腺癌的新型疗法。综上,本文研究结果表明,利用多个独立的数据库,基于细胞相关的细菌的特征或许就能帮助预测胰腺癌患者的临床预后,而肿瘤微生物组的串扰或许能调节胰腺癌的肿瘤发生,具有重要的临床管理意义。
【3】Science:揭示肠道微生物在人类肠道环境中与人类共同进化了数十万年
TAICHI A.SUZUKI,J.LIAM FITZSTEVENS,VICTOR T. SCHMIDT,et al.Codiversification of gut microbiota with humans. Science,2022,doi:10.1126/science.abm7759.
人类的肠道微生物组由数千种不同的细菌和古细菌(archaea)组成,这些细菌和古细菌在不同的人群和个体之间有很大的差异。近日,一篇发表在国际杂志Science上题为“Codiversification of gut microbiota with humans”的研究报告中,来自德国马克斯-普朗克生物研究所的研究人员通过研究发现了与人类宿主有着平行进化历史的肠道微生物:这些肠道微生物在人类肠道环境中与人类共同进化了数十万年。此外,一些肠道微生物表现出的基因组特征和功能特征使得它们依赖于其宿主。这些研究结果是根据来自非洲、亚洲和欧洲的1225人的数据获得的。
人类肠道中的许多微生物物种可以在世界各地的人群中找到。然而,就一种微生物物种中,不同个体和人群的微生物菌株有很大的不同。尽管它们对人类健康很重要,但迄今为止对这些菌株的来源知之甚少。此外,这些菌株中的大多数几乎只生活在人类的肠道中。这就提出了一个问题:人类肠道中的微生物来自哪里。作者推测,随着人类在全球的多样化和扩散,特定的微生物物种和菌株一直伴随着人类。为了测试微生物是否与它们的人类宿主同时进化和多样化,他们首次系统地比较了人类和肠道微生物的进化史。
这些作者为1225名人类研究参与者以及在他们的肠道内发现的59种微生物创建了系统发育树,并使用统计测试来研究这些系统发育树的匹配程度。超过60%的被调查微生物物种与它们的人类宿主的进化史相匹配,这意味着当人类横跨各大洲的时候,这些微生物在人类肠道中与人类一起共同多样化了大约10万年。论文通讯作者、马克斯-普朗克生物学研究所微生物组科学系主任Ruth Ley说,“我们不知道我们的任何肠道微生物如此紧密地跟随我们的进化史。”
这些研究结果有助于进一步了解长期以来与当地人类相关的特定人群微生物。有了这些知识,基于肠道微生物组的疾病疗法可以针对特定人群进行调整和优化。
【4】Science:科学家或有望利用肠道微生物来开发治疗人类精神疾病的新型疗法
Jane A. Foster. Modulating brain function with microbiota. Science (2022).doi: 10.1126/science.abo4220
多年以来,微生物组在肠道和机体系统性健康中的作用已经引起了科学家们的密切关注,如今,越来越多的研究证据表明,人类肠道中的这种微生物集合也影响着一个人的神经和情绪健康,近日,一篇发表在国际杂志Science上题为“Modulating brain function with microbiota”的研究报告中,来自麦克马斯特大学等机构的科学家们就通过研究发现,肠道微生物组或许有望帮助开发治疗人类精神疾病的新型疗法。
文章中,研究人员概述了科学家们如何解开微生物组和机体大脑之间的关联,包括与诸如抑郁症和肌萎缩侧索硬化症等疾病之间的关联,研究者Foster博士首次发现了小鼠肠道内的微生物与机体焦虑症之间的关联,而通过对动物研究后,研究者揭示了特定微生物群落和增加机体焦虑症样行为和大脑功能的相关代谢产物,将这些研究结果转化到临床人群中或许有望帮助开发改善疾病症状和临床治疗结果的新型疗法。
这篇研究报告中,研究人员揭示了人类机体中39万亿个肠道微生物与大脑疾病倾向之间的关联,研究者Foster指出,有抑郁症风险或被诊断为抑郁症的患者具有一定的异质性,因此,我们希望能利用生物学机制来理解能帮助定义不同人群的特殊生物标志物。如果研究人员能为遭受精神疾病的患者找到治疗的答案,这种全面的方法或许就是非常有必要的。此外,研究人员还对单向和双向抑郁症进行了研究旨在更好地理解抑郁症发病的原因,从而识别出新型疗法并改善当前的疗法。
【5】Cell:科学家构建出一种由100多种细菌物种组成的合成肠道微生物组 有望开发出微生物组疗法治疗一系列疾病
Alice G. Cheng,Po-Yi Ho,Andrés Aranda-Díaz,et al. Design,construction,and in vivo augmentation of a complex gut microbiome. Cell,2022,doi:10.1016/j.cell.2022.08.003.
过去十年的关键研究已表明肠道微生物组,即生活在人类消化系统中的成百上千种细菌的集合,影响着神经发育、对癌症免疫疗法的反应以及健康的其他方面。但这些群体是复杂的,如果没有系统的方法来研究其成分,与某些疾病有关的确切细胞和分子仍然是一个谜。
近日,一篇发表在国际杂志Cell上题为“Design, construction, and in vivo augmentation of a complex gut microbiome”的研究报告中,来自美国斯坦福大学的研究人员通过研究建立了最复杂和明确定义的合成微生物组(synthetic microbiome),构建出一种由100多种细菌物种组成的细菌群落,并成功将地它们移植到小鼠体内。添加、移除和编辑单个细菌物种的能力将使科学家们更好地了解微生物组与健康之间的联系,并最终开发出一流的微生物组疗法。
微生物组中的每个细胞都占据着一个特定的功能生态位,进行分解和合成分子的反应。为了建立一种微生物组,这些作者必须确保最终的细菌混合物不仅是稳定的,保持平衡,没有任何单一物种压倒其他物种,而且每个物种是功能性的,所有物种一起执行一种完整的天然微生物组的所有行动。鉴于不同物种间的自然差异,选择物种纳入他们的合成微生物组也很困难;随机选择的两个人只有不到一半的微生物基因是相同的。这些作者决定从最普遍存在的细菌中建立他们的菌落,并求助于人类微生物组计划(Human Microbiome Project, HMP)。HMP是美国国家卫生研究院发起的一项对300多名成年人的完整微生物基因组进行测序的计划。
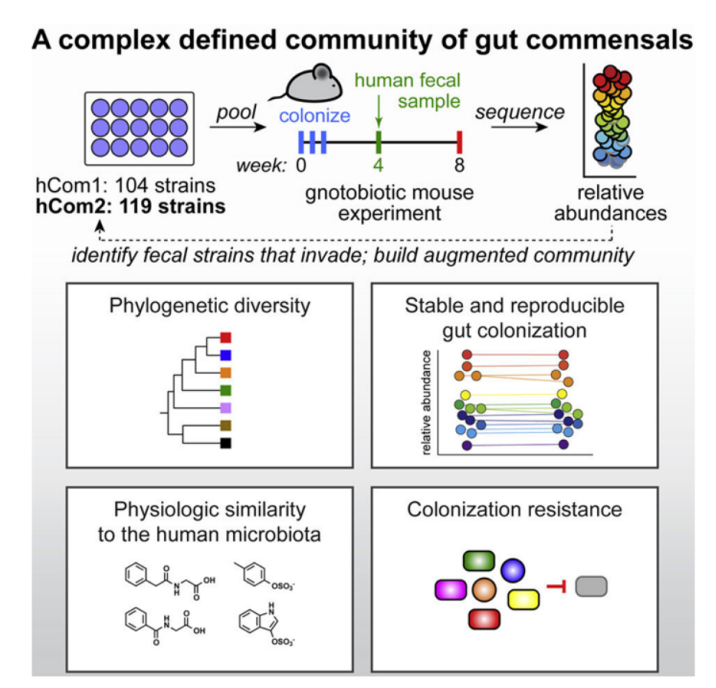
图片来源:Cell, 2022, doi:10.1016/j.cell.2022.08.003
研究者Fischbach表示,我们正在寻找人类肠道中的细菌物种,试图找到任何个体中几乎总是存在的细菌。”他们选择了至少在20%的HMP个体中存在的100多种细菌菌株。再加上一些后续研究所需的一些物种,使他们获得了104种细菌物种,每个细菌物种在单独的种群中生长,然后将其混合到一个联合培养物中,形成他们所说的人类群落1(human community one, hCom1)。尽管对这些菌株能够在实验室中共存感到满意,但真正的测试是他们的新菌落是否会在肠道中扎根。他们将hCom1引入精心设计的没有细菌存在的小鼠体内。hCom1非常稳定,98%的组成物种在这些无菌小鼠的肠道中定植,并且每个新物种的相对丰度水平在两个月内保持不变。
【6】Cell:揭示高糖饮食中的糖破坏肠道微生物组,使哺乳动物易患肥胖、糖尿病和代谢综合征
Yoshinaga Kawano,Madeline Edwards,Yiming Huang,et al. Microbiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome. Cell,2022,doi:10.1016/j.cell.2022.08.005.
近日,一篇发表在国际杂志Cell上题为“Microbiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome”的研究报告中,来自哥伦比亚大学等机构的科学家们通过研究发现,饮食中的糖改变了肠道微生物组,引发了一连串的事件,最终导致代谢疾病、前期糖尿病(pre-diabetes)和体重增加。这一结果表明,饮食很重要,但最佳的肠道微生物组对于预防代谢综合征、糖尿病和肥胖同样重要。西式的高脂肪、高糖饮食可导致肥胖、代谢综合征和糖尿病,但饮食如何在体内启动不健康的变化尚不清楚。
肠道微生物组对于动物的营养是不可或缺的,因此研究者Ivalyo Ivanov博士及其同事研究了西式饮食对小鼠肠道微生物组的初步影响。在摄入这种高脂肪、高糖饮食四周后,这些小鼠表现出代谢综合征的特征,如体重增加、胰岛素抵抗和葡萄糖不耐受。它们的肠道微生物组发生了巨大的变化,分段丝状细菌---在啮齿动物、鱼和鸡的肠道菌群中很常见---的数量急剧下降,而其他细菌的丰度增加。
这些作者发现通过对Th17免疫细胞的影响,分段丝状细菌的减少对这些小鼠的健康至关重要。分段丝状细菌的减少降低了肠道中Th17细胞的数量,而进一步的实验显示,正是Th17细胞对于预防代谢性疾病、糖尿病和体重增加是必要的。研究者表示,这些免疫细胞产生的分子减缓了肠道对'坏'脂质的吸收,它们减少了肠道炎症。换句话说,它们保持肠道健康,保护身体不吸收致病性脂质。
【7】Cell:非营养性甜味剂或能影响人类机体的微生物组并改变机体的血糖反应
Jotham Suez,Yotam Cohen,Rafael Valdés-Mas,et al. Personalized microbiome-driven effects of non-nutritive sweeteners on human glucose tolerance,Cell (2022). doi: 10.1016/j.cell.2022.07.016
自19世纪末以来,非营养性的甜味剂一直承诺提供糖的所有甜味,且没有任何卡路里,长期以来这类甜味被认为对人类机体并没有任何效应,然而近日,一篇发表在国际杂志Cell上题为“Personalized microbiome-driven effects of non-nutritive sweeteners on human glucose tolerance”的研究报告中,来自以色列魏茨曼科学研究所等机构的科学家们通过研究对这一观点提出了挑战,他们发现,这些糖类替代物并不是惰性的,事实上,有些非营养性甜味剂或能以一种特殊方式改变人类消费者机体的微生物组,从而改变其机体的血糖水平。
早在2014年,研究者Eran Elinav等人就通过研究发现,非营养性的甜味剂或会影响小鼠机体的微生物组,从而影响其机体的血糖反应,研究人员非常感兴趣分析是否这些研究结果也在人类机体中存在,为了解决这一重要的问题,研究人员仔细筛查了1300多名在日常生活中严格避免摄入非营养性甜味剂的个体,并确定了由120人组成的研究对象,这些参与者被分为6组,两组对照和另外四组摄入阿斯巴甜、糖精、甜叶菊或三氯蔗糖的研究组,其摄入的剂量远低于FDA的每日允许量。
研究者Elinav说道,在摄入非营养性甜味剂的受试者中,我们能够发现研究对象机体肠道微生物的组成和功能会发生非常不同的改变,而且其分泌到外周血中的分子也会发生明显改变;这似乎就表明,人类机体中的肠道微生物对这些甜味剂中的每一种都会产生反应;当研究者将摄入非营养性甜味剂的参与者作为群体进行研究时,他们发现其中两种非营养性甜味剂:糖精和三氯蔗糖或许会明显影响健康成年人机体的葡萄糖耐受性,有趣的是,其机体中微生物群的改变与机体血糖反应的改变高度相关。综上,本文研究结果表明,人类非营养性甜味剂的摄入或能诱导个体特异性、微生物组依赖性的血糖改变,因此后期研究人员非常有必要进行临床应用的评估。
【8】Science:狩猎采集社会婴儿的肠道微生物组与城市地区婴儿或存在显著差异
MATTHEW R. OLM,DYLAN DAHAN,MATTHEW M. CARTER,et al. Robust variation in infant gut microbiome assembly across a spectrum of lifestyles. Science,2022,doi:10.1126/science.abj2972.
近日,一篇发表在国际杂志Science上题为“Robust variation in infant gut microbiome assembly across a spectrum of lifestyles”的研究报告中,来自斯坦福大学等机构的科学家们通过研究发现,生活在坦桑尼亚一个狩猎采集社会的婴儿的肠道微生物组与生活在现代城市地区的婴儿的肠道微生物组有明显的区别。在这篇论文中,他们对从坦桑尼亚哈扎(Hadza)部落婴儿获得的100多份粪便样本进行了核糖体RNA测序,并将测序数据与公共数据库中存储的类似数据进行了比较。
这些作者收集了生活在坦桑尼亚的几十名哈扎部落婴儿的粪便样本,以及从23名婴儿的母亲那里收集的粪便样本。随后,他们对所有的样本进行了核糖体RNA测序,以确定其肠道中构成生物群落的细菌种类。他们将坦桑尼亚婴儿的肠道微生物组的多样性与生活在世界各地现代城市地区的婴儿的肠道微生物组进行了比较。他们发现,大约六个月后,与生活在城市地区的婴儿相比,哈扎部落婴儿的肠道中具有更多的多样性。他们还发现,在哈扎部落婴儿的肠道微生物组中发现的大约20%的细菌类型以前没有被记录下来。
这些作者还发现,这些肠道微生物组方面的差异可以追溯到这些哈扎部落婴儿的母亲,以及当地环境的一些影响。他们还表示,肠道微生物组差异的主要原因似乎与生活方式而不是地理环境有关。他们还推测,城市地区的肠道微生物组多样性较低与工业化国家更常见的疾病(比如与炎症有关的疾病)之间可能存在联系。
【9】JAMA Oncol:肠道微生物组或会改变患者对癌症疗法的反应
Longsha Liu,Khalid Shah. The Potential of the Gut Microbiome to Reshape the Cancer Therapy Paradigm:A Review,JAMA Oncology (2022). doi:10.1001/jamaoncol.2022.0494
自古以来,机体的肠道微生物组就一直是大量细菌、病毒、者均和其它微生物的家园,其被认为会影响人类机体健康的多个方面,最近,测序技术研究显示,肠道微生物组或许在癌症疗法中国也发挥着重要作用,近日,一篇发表在国际杂志JAMA Oncology上题为“The Potential of the Gut Microbiome to Reshape the Cancer Therapy Paradigm:A Review”的综述文章中,来自布莱根妇女医院等机构的科学家们通过研究深入揭示了机体肠道微生物组和机体对免疫疗法、化疗和癌症手术等治疗手段所产生的反应之间的关联,相关研究结果或有望帮助开发新方法来靶向作用微生物组从而改善患者的治疗。

图片来源:https://jamanetwork.com/journals/jamaoncology/article-abstract/2791672
研究者Khalid Shah说道,我们都知道,健康的肠道对于机体的整体健康至关重要,我们的肠道之所以如此重要,因为我们经常将其称之为我们的“第二大脑”,近年来,科学家们开始意识到肠道的多方面作用,包括脑肠轴、肠道和机体免疫系统之间的关联,繁殖,肠道功能的紊乱或许就会对机体健康产生负面影响。
这篇研究报告中,研究人员报告了肠道微生物组在免疫疗法中所扮演的一种新角色,免疫检查点抑制剂和免疫检查点阻滞疗法是两种治疗癌症的新型疗法,但对这些形式治疗手段的反应在不同个体之间以及不同的癌症类型之间或许存在很大差异。一些研究发现,在对疗法产生应答的个体和无反应的个体机体的粪便中的细菌种类存在一定的差异,这或许就表明,不同的微生物组组成或许会影响个体的临床反应。而其它研究结果则发现,饮食和益生菌以及抗生素疗法和噬菌体都可以影响机体肠道微生物组的组成,反过来还会影响机体对免疫疗法的反应,尤其是,研究者强调了最近关于生酮饮食对癌症患者所产生影响的相关研究。
【10】Cell Host & Microbe: 高脂饮食促进代谢障碍的肠道微生物节律
Katya Frazier,Amal Kambal,Elizabeth A. Zale,et al. High-fat diet disrupts REG3g and gut microbial rhythms promoting metabolic dysfunction. Cell Host Microbe. 2022 Apr 12 doi:10.1016/j.chom.2022.03.030
现代社会昼夜节律紊乱导致代谢性疾病发病率上升。昼夜节律是行为和生物过程中的24小时振荡,部分由体内几乎所有细胞中都存在的核心昼夜时钟(CC)转录-翻译反馈环驱动。这些节律对主要代谢和免疫途径的调节至关重要,在这些途径中,近一半的小鼠转录组处于CC控制之下。当昼夜节律改变或不起作用时,就会出现不利的代谢后果,包括肥胖增加和胰岛素敏感性受损。肠道微生物的昼夜振荡是宿主昼夜节律和新陈代谢的重要饮食驱动因素,确保了能量的最佳平衡。然而,饮食、微生物和维持肠道振荡的宿主因素之间的相互作用是复杂的,而且知之甚少。
近日,一篇发表在国际杂志Cell Host & Microbe上题为“High-fat diet disrupts REG3g and gut microbial rhythms promoting metabolic dysfunction”的研究报告中,来自芝加哥大学等机构的科学家们通过研究揭示了恢复肠道微生物群感知特定宿主因子(如Reg3g)介导的饮食信号的能力可以用来改善代谢功能障碍。
在本研究中,研究者使用小鼠模型,报告宿主C型凝集素抗菌肽Reg3g与关键的回肠微生物以双向方式协调这些相互作用,而与肠道核心生物钟无关。高脂饮食是微生物振荡器的主要驱动力,微生物振荡器破坏宿主代谢的动态平衡,导致心律失常的宿主Reg3g表达,继而推动关键肠道微生物的丰富和振荡。这说明生物节律的跨界协调主要受饮食和宿主和微生物成分之间相互的传感器-效应器信号的影响,最终驱动新陈代谢。
【11】Nat Med: 科学家揭示肠道微生物与癌症免疫疗法反应相关性
McCulloch,J.A.,Davar, D., Rodrigues,R.R. et al. Intestinal microbiota signatures of clinical response and immune-related adverse events in melanoma patients treated with anti-PD-1. Nat Med 28,545–556 (2022). doi:10.1038/s41591-022-01698-2
肠道微生物组已成为免疫检查点阻断(ICB)的肿瘤外在预测生物标志物。已有证据表明,肠道微生物组作为一种肿瘤外源性因素,与抗肿瘤对抗程序化细胞死亡蛋白-1 (PD-1)治疗的反应相关,微生物组调节可以提高对抗PD-1 ICB的反应性。然而,与临床结局相关的已发表微生物特征之间存在不一致。目前还不清楚微生物组是否对ICB治疗的有效性产生积极或消极的影响,以及在治疗过程中微生物组作用的最重要节点。
为了解决这一问题,近日,一篇发表在国际杂志Nature Medicine上题为“Intestinal microbiota signatures of clinical response and immune-related adverse events in melanoma patients treated with anti-PD-1”的研究报告中,来自美国国家癌症研究所的研究人员进行了针对性研究,结果发现不同地理分布的肠道微生物特征(微生物型)与PD-1反应差异相关,并部分解释了队列之间的差异。
在该研究中,研究人员评估了一个新的黑色素瘤队列,以及四个已发布的数据集。分析PD-1治疗的黑色素瘤患者的大量微生物组样本,将事件发生时间结果与包括药物,嗜中性粒细胞与淋巴细胞比值(NLR)和irAE在内的变量相结合。研究人员确定了与特定 irAE 特征和结局相关的不同微生物特征,以及与不利临床反应相关的全身性和肠道脂多糖 (LPS)依赖性炎症状态。
研究人员使用相同的生物信息学方法对来自新队列和四个已发表的PD-1治疗黑色素瘤患者的独立队列的微生物测序数据进行了荟萃分析。跨队列微生物组训练的机器学习始终如一地预测PD-1治疗的结果,尽管队列之间存在异质性。总之,该项研究结果揭示了肠道微生物组与癌症免疫疗法反应之间的复杂相互作用,为未来的研究提供了方向。
【12】Cell:合成基因元件的跨物种表达有助发现人类微生物组衍生性的代谢物
Jaymin R. Patel,Joonseok Oh,Shenqi Wang,et al. Cross-kingdom expression of synthetic genetic elements promotes discovery of metabolites in the human microbiome. Cell,2022,doi:10.1016/j.cell.2022.03.008.
超过60%的药物,包括抗生素和癌症治疗药物,都来自于由代谢基因编码的小分子形式的天然产物。这些分子通常形成复杂的化学结构,而且是在包括细菌、植物和人类在内的多种生命形式中经过数十亿年的进化而形成的。然而,使这些结构成为可能并因此维持生命的数十万个遗传途径在很大程度上仍未得到探索,部分原因是不同物种之间的遗传和分子相互作用的变化的极其复杂性。近日,一篇发表在国际杂志Cell上题为“Cross-kingdom expression of synthetic genetic elements promotes discovery of metabolites in the human microbiome”的研究报告中,来自耶鲁大学的研究人员开发出一种新的合成生物学技术,作为一种通用的翻译工具,可以追踪不同有机体内以前未曾探索过的基因和代谢事件。
研究者Farren Isaacs表示,你可以把它看作是一种通用的遗传语言,一种可以解开生命的隐藏基因和分子的可靠线索。”他说,需要探索的新领域之一是人类微生物组。在人类微生物组中,数万亿的细菌与它们的宿主相互作用,并对人类健康产生深远影响。人类微生物组和人体细胞之间的遗传相互作用为提高对疾病的理解和开发新的医疗疗法提供了巨大的前景。然而,在影响这些物种间相互作用的所有潜在遗传途径中,只有不到1%的遗传途径得到了探索。
对这些遗传途径的研究一直受到阻碍,因为无法在微生物的天然环境之外和实验室条件下培养它们。编码这些代谢物的基因经常被沉默,使得发现天然产物成为不可能。为了研究这些相互作用,Isaacs和论文共同通讯作者、耶鲁大学生物分子设计与发现研究所主任Jason Crawford及其团队利用计算生物学和DNA合成技术构建出由他们开发的计算机辅助设计软件产生的“合成基因元件(synthetic genetic element,SGE)”,并利用所产生的SGE重新设计了遗传途径:基因及其调控区域,使它们能够在包括革兰氏阴性菌和、革兰氏阳性菌和真核生物在内的各种宿主有机体中表达,从而将生物合成能力与宿主范围的限制脱钩,激活沉默的遗传途径,基于此,他们确定了它们的分子功能。
【13】Nature:肠道微生物代谢物可影响大脑活动并导致焦虑行为
Brittany D. Needham,Masanori Funabashi,Mark D. Adame, et al. A gut-derived metabolite alters brain activity and anxiety behaviour in mice. Nature 602,647–653 (2022). doi:10.1038/s41586-022-04396-8
动物行为受环境中各种感官和分子因素的影响。胃肠道是受环境分子影响的一个主要部位,在这里,饮食成分被微生物群化学转化,肠道衍生的代谢物扩散到包括大脑在内的所有器官。前期研究表明,在小鼠中,肠道微生物群影响行为,调节肠道和大脑中的神经递质产生,并影响大脑发育和髓鞘形成模式。目前,尽管介导肠-脑相互作用在体液或神经元连接中起着重要作用,但是其相互作用机制仍不清楚。加州理工学院生物与生物工程系的学者曾在不典型神经发育的小鼠模型中检测到微生物代谢物4-乙基苯基硫酸酯(4EPS)的水平升高,他们进一步研究了这一肠道微生物代谢物对大脑活性的影响。相关研究结果“A gut-derived metabolite alters brain activity and anxiety behaviour in mice”发表在了Nature上。
在这项研究中,研究人员从肠道微生物中鉴定了介导饮食中酪氨酸转化为4-乙基酚(4EP)的生物合成基因,以及生物工程肠道细菌选择性地产生4EPS的基因。他们利用缺乏微生物群的无菌(GF)小鼠,并在不同的GF小鼠群中定植了两种工程菌株,构建了4EP+或4EP-小鼠。通过建立一个简化的动物模型,重现了暴露于肠道微生物代谢物的行为改变的自然路径。为了研究4EP(S)对小鼠大脑的影响,学者们进行了功能超声成像(fUSi)——一种测量静息状态脑血容量变化的体内方法,以评估功能连通性。研究发现,4EPS进入大脑,4EPS的升高与小鼠大脑各区域间异常的功能连接有关。
综上,本文研究结果表明,一种来自肠道的分子通过影响大脑中的少突胶质细胞功能和髓鞘模式来影响小鼠的复杂行为。
【14】Nat Med:肠道微生物可预测晚期非小细胞肺癌生存率
Derosa,L.,Routy,B.,Thomas,A.M. et al. Intestinal Akkermansia muciniphila predicts clinical response to PD-1 blockade in patients with advanced non-small-cell lung cancer. Nat Med 28, 315–324 (2022). doi:10.1038/s41591-021-01655-5
靶向PD-1-PD-L1相互作用的免疫检查点抑制剂(ICIs)的发展已经改变了晚期NSCLC1患者的治疗前景。对既往治疗的晚期非小细胞肺癌(NSCLC)患者进行的试验表明,与标准化疗相比,PD-1-PD-L1阻断治疗后的总生存期(OS)更高。然而,只有少数(35%)患者从ICI的持续反应中受益。大多数非小细胞肺癌患者出现原发性或继发性耐药性,或偶尔出现疾病的快速加速,即超进展。因此,迫切需要了解ICI的耐药机制,以识别新的、强有力的耐药生物标志物。已有研究表明,在癌症患者中,肠道微生物群的组成在影响外周免疫紧张和ICIs有效性方面具有生物学意义,肠道微生物群可能有助于ICIs16的免疫刺激作用模式。微生物群的多样性和特定细菌的存在,如肠道嗜粘液细菌Akkermansia muciniphila (Akk)或瘤胃球菌或双歧杆菌属,与ICI的临床反应改善和系统免疫强度增加有关。
近日,一篇发表在Nature Medicine上题为“Intestinal Akkermansia muciniphila predicts clinical response to PD-1 blockade in patients with advanced non-small-cell lung cancer”的研究报告中,来自法国巴黎-萨克雷大学等机构的科学家们通过研究发现,Akk可以预测晚期NSCLC患者的12个月生存率。

粪便中的Akk与ICI临床受益有关
图片来源:Nat Med 28,315–324 (2022). doi:10.1038/s41591-021-01655-5
在本研究中,研究人员对338名接受一线或二线ICIs治疗的晚期NSCLC患者进行了基于宏基因组学的微生物组分析,前瞻性验证了粪便Akk的预测价值。研究结果显示,肠道Akk与客观缓解率和总生存率的增加相关,与PD-L1表达、抗生素和功能状态无关。同时,研究人员利用小鼠模型验证了该结论。研究进一步探讨了肠道Akk和肿瘤组织(鳞状和非鳞状NSCLC)之间的相互作用,结果表明Akk的存在与非小细胞肺癌患者肠道微生物群和肿瘤微环境中重要的、潜在的预后相关的变化有关。
肠道Akk伴随着更丰富的共生关系,包括哈利真杆菌和青春期双歧杆菌,在一部分患者中,肿瘤微环境炎症更严重。然而,抗生素的使用(20%的病例)与Akk的相对优势度为4.8%以上同时伴有梭状芽胞杆菌属,与ICI耐药有关。另外,研究人员意外发现,在OS < 12个月的Akk+组患者中Akk的过度表达。这表明Akk的相对丰度可能比它的绝对存在或不存在更能影响预后。AKK的相对丰度可能是未来研究中细化患者分层的潜在生物标志物。研究人员利用肿瘤小鼠模型研究了Akk和/或其附属生态系统和患者临床结果之间的联系,发现小鼠对抗PD-1抗体的耐药性与缺失Akk的粪便微生物移植相关。
【15】Nat Med:科学家揭示肠道微生物与冠状动脉疾病的相关性
Talmor-Barkan,Y.,Bar,N.,Shaul,A.A. et al.Metabolomic and microbiome profiling reveals personalized risk factors for coronary artery disease. Nat Med 28,295–302 (2022). doi:10.1038/s41591-022-01686-6
冠状动脉疾病(CAD)是世界范围内发病率和死亡率的主要原因。CAD的发生往往是多因素的,由多种潜在的病理机制引起。已有研究表明,肠道微生物群积极参与血液代谢产物的代谢,多种肠道微生物来源的循环代谢物与心血管疾病有关。近日,一篇发表在国际杂志Nature Medicine上题为“Metabolomic and microbiome profiling reveals personalized risk factors for coronary artery disease”的研究报告中,来自以色列拉宾医学中心等机构的科学家们通过研究利用代谢组学和微生物组学揭示了冠状动脉疾病的个体化危险因素。
在这项研究中,研究人员对来自以色列两家主要医院的199名急性冠脉综合征(ACS)患者进行了全面的临床和多组学分析,包括血清代谢组学和肠道微生物组数据等。结果显示,与970名非ACS患者组成的对照组相比,ACS患者的变形杆菌菌群丰度更高,而变形杆菌通常在炎症状态下大量繁殖,是生物失调的标志。研究人员发现20个细菌基因组在ACS或对照个体中显着富集,其中梭状芽胞杆菌科细菌(SGB 4712)是一种以前未知的细菌,在ACS队列中消失殆尽。
SGB 4712与对照组中多种循环代谢物的水平有关,其中一些代谢物已被证实与CAD风险增加有关,包括甲酚葡萄糖醛酸、对甲酚硫酸盐、硫酸吲哚氧基和苯乙酰谷氨酰胺等。综上,该项研究利用血清代谢组和宏基因组揭示CAD危险因素,揭示了CAD新的模式和治疗方向,为未来可能的临床试验和研究奠定基础。
【16】Nature:揭示肺部微生物组调节大脑自身免疫
Hosang,L.,Canals,R.C.,van der Flier,F.J. et al. The lung microbiome regulates brain autoimmunity. Nature 603, 138–144 (2022). doi:10.1038/s41586-022-04427-4
在为身体提供氧气的重要功能中,肺部通过一个大的交换面与外界环境相连接。在肺组织和外界空气之间的这个边界居住着一种特殊的微生物菌群,即所谓的肺部微生物组(lung microbiome)。这种微生物组的确切功能在以前几乎没有被研究过。
近日,一篇发表在国际杂志Nature上题为“The lung microbiome regulates brain autoimmunity”的研究报告中,来自德国哥廷根大学学等机构的科学家们通过研究发现了肺部微生物组与大脑之间存在密切关系。他们发现,肺部微生物组能调节小胶质细胞---大脑的免疫细胞---的活性。这个新确定的肺-脑轴(lung-brain axis)对疾病过程具有重要意义:肺部微生物组的确切组成决定了在大脑中发生自身免疫性炎症的易感性,如在多发性硬化症中发生的那样。
这项新的研究指出了肺部和大脑之间新的、意想不到的功能联系。这种联系是由当地的肺部微生物组调节的,它显然在不断地向小胶质细胞---大脑的“免疫细胞”---发出信号。研究者Leon Hosang博士表示,小胶质细胞根据这些微生物信号调整它们自身的免疫反应能力,因此可以对即将到来的威胁做出快速反应。Odoardi教授解释道因此,肺部微生物组可以被看作是敏感的脑组织的早期预警系统。”这可能对我们的健康产生影响:肺部感染、治疗性操作(抗生素治疗)、污染和气候变化都会对肺部微生物组产生影响,从而影响大脑的免疫反应性。
【17】Nat Med:健康的肠道微生物组或能改善癌症免疫疗法的治疗成功率
Lee, K.A.,Thomas,A.M.,Bolte,L.A. et al. Cross-cohort gut microbiome associations with immune checkpoint inhibitor response in advanced melanoma. Nat Med (2022).doi:10.1038/s41591-022-01695-5
肠道微生物组的组成与机体对免疫检查点抑制剂(ICI)疗法的反应直接相关,但科学家们对特定微生物组特征与ICIs的临床效益之间的关联的共识非常有限。近日,一篇发表在国际杂志Nature Medicine上题为“Cross-cohort gut microbiome associations with immune checkpoint inhibitor response in advanced melanoma”的研究报告中,来自伦敦大学国王学院等机构的科学家们通过进行迄今为止最大规模的研究证实了肠道微生物组和机体对黑色素瘤癌症免疫疗法的反应直接相关。
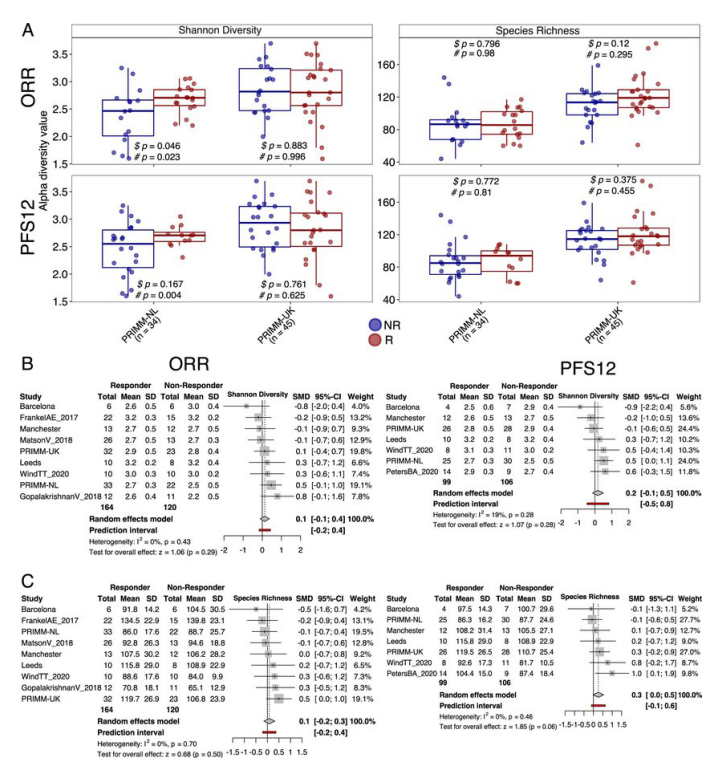
α多样性和反应之间的关联
图片来源:Nat Med (2022).doi:10.1038/s41591-022-01695-5
这项研究汇集了来自英国、荷兰和西班牙5个临床研究中心最大的黑色素瘤患者队列以及样本,研究人员进行了大规模的宏基因组研究(对肠道微生物组进行测序),旨在调查是否肠道微生物组的组成和功能与机体对免疫疗法反应之间存在一定的关联。研究结果证实了一种非常复杂的关联,其主要涉及不同患者群体机体中的不同细菌种类,研究者表示,三种类型的细菌似乎都与患者机体出现更好的免疫反应有关,即假小链双歧杆菌(Bifidobacterium pseudocatenulatum)、罗氏菌属(Roseburia spp)和Akkermansia muciniphila。另一项研究发现则是,微生物组自身或许还受到了多种因素的强烈影响,包括患者的体质、使用质子泵抑制剂和饮食等,这些饮食或许应该在未来的纵向研究中予以考虑。
综上,研究者指出,研究微生物组对于改善和开发治疗黑色素瘤的个体化免疫疗法至关重要,由于不同个体的肠道微生物组之间存在一定的差异,因此后期研究人员还必须进行更大规模的研究来理解可能会导致机体对免疫疗法产生积极反应的特定肠道菌群特征。
【18】PNAS:机体的微生物组能塑造你的生活?那么其是从何而来呢?
Eric W. Jones,Jean M. Carlson,David A. Sivak, et al. Stochastic microbiome assembly depends on context,Proceedings of the National Academy of Sciences (2022).doi:10.1073/pnas.2115877119
肠道微生物组是一个由生活在人类机体中的数百至数千种微生物群落所组成的生态协同,这些群落影响着人类的健康、生育能力甚至寿命,那么它们首先会到达哪里呢?近日,一篇发表在国际杂志PNAS上题为“Stochastic microbiome assembly depends on context”的研究报告中,来自西蒙弗雷泽大学等机构的科学家们通过研究揭示了关于组成我们每个人机体肠道微生物群落是如何获得的关键细节信息,相关研究结果对于诸如粪便移植和益生菌管理等治疗方法有着非常重要的影响。
研究者Ludington解释道,个体之间的微生物组组成存在着巨大差异,比如,如果你看一下适应生活在人类胃肠道系统中的所有细菌群落的综合,其中大多数并不存在于大部分人机体中,这就是这些肠道菌群拥有难以置信的多样性的原因了。包括遗传学、饮食和环境在内的多种元素的组合或会促进机体微生物组之间的差异,但是,这些输入信息和成功定植到肠道中的物种之间似乎并没有直接的关联,每次当我们接触到一种新的微生物时,其是否会被吸收并成为我们机体肠道生态系统中的一员,都有一个就会因素在发挥着作用,研究人员决定开始理解能重塑这种定植过程几率的风险因素。
研究者Sivak说道,即使生活在一起被喂食相同饮食的遗传结构相同的果蝇,我们也能够发现其机体微生物组组成的差异。随后研究人员利用这些研究结果建立了数学模型,并来探究越来越复杂的情况,通过这些情况就能获得新的微生物组物种,从而就能帮助理解塑造微生物组生态系统成员的社区因素。我们可以将微生物组组成想象成一个大聚会。社会动态决定了谁能早早地离开,谁能够呆到黎明。综上,本文研究结果对于研究人员开发微生物组疗法(比如粪便微生物群落移植疗法等)具有重要的意义,这些疗法能尝试通过引入外来微生物来改变一个人的肠道微生物组。
【19】Cell:科学家揭示人类日常饮食、肠道菌群和微生物代谢产物之间的神秘关联
Sun-Yang Park,Chitong Rao,Katharine Z. Coyte, et al. Strain-level Fitness in the Gut Microbiome Is an Emergent Property of Glycans and a Single Metabolite,Cell (2022). doi:10.1016/j.cell.2022.01.002
我们都知道,生活在机体肠道中的微生物(微生物组)会以多种方式来影响机体的健康,竞争性微生物群落之间的平衡被认为在人类炎性肠病、免疫功能紊乱、神经变性疾病、癌症等多种疾病发生过程中扮演着重要角色。我们所摄入的饮食中的糖分会反过来影响微生物群落的平衡,即哪些微生物会不断生长,而哪些则不会生长;此外,微生物所分泌的成千上万种不同的代谢产物也会影响其彼此的生存,乃至宿主机体的健康。
近日,一篇发表在国际杂志Cell上题为“Strain-level fitness in the gut microbiome is an emergent property of glycans and a single metabolite”的研究报告中,来自波士顿儿童医院等机构的科学家们通过研究深入揭示了饮食、肠道菌群及其代谢产物之间的神秘关联;同时研究人员理解了这些复杂的部分是如何结合在一起的,文章中,研究人员重点对人类肠道中最主要的革兰氏阴性菌拟杆菌属(Bacteroides)进行了相关研究。
研究者表示,我们需要理解肠道微生物组中的每个物种,尤其是拟杆菌属细菌是如何在机体肠道中存活的,尤其是在我们想增强或减少它们时。肠道菌群能够竞争使用我们饮食中未消化的糖类来作为其能量来源,其中一些细菌有一半的基因组是专门用来如何更好地利用这些糖类的。研究者Rakoff-Nahoum及其同事系统性地检测了肠道中的代谢产物如何影响拟杆菌属细菌生长的,其中一种代谢产物会明显抑制某些拟杆菌,即一种名为丁酸盐的短链脂肪酸,其在宿主机体中扮演着至关重要的角色,包括免疫系统的发育等。当研究人员在人类饮食的不同糖类中培养拟杆菌时,他们发现,丁酸盐的抗微生物效应取决于每种细菌使用了什么样的糖类。
研究者表示,如果你将任何两种菌株放到糖类X中生长(在丁酸盐存在的情况下),A菌株就会被杀灭,而B菌株的生长状况就好像丁酸盐完全不存在一样。而在糖类Y中,研究人员恰恰观察到了相反的情况,即B菌株能被丁酸盐杀灭,而A菌株则不受任何影响。为何丁酸盐会杀灭某些拟杆菌而不是其它细菌呢?本文研究确定了第三个层面,即遗传因素,影响辅酶A代谢的基因的轻微变异会导致不同拟杆菌属细菌对丁酸盐敏感性的差异。
综上,本文研究结果表明,拟杆菌属中的每一个菌株似乎都存在于一个特定的适应性环境中,而这是基于由核心基因组中灵活性所介导的每个部分单独影响而无法预测的化学组分的相互作用。
【20】EbioMedicine:揭示多发性硬化症患者机体肠道真菌微生物组发生改变的分子机制
Saumya Shah,Alberto Locca,Yair Dorsett,et al. Alterations of the gut mycobiome in patients with MS,Ebiomedicine (2022) doi:10.1016/j.ebiom.2021.103557
真菌微生物组(mycobiome)是肠道微生物组的真菌组分,其与多种自身免疫性疾病的发生有关,然而,目前研究人员并不清楚真菌微生物组在多发性硬化症发生过程中所扮演的关键角色。近日,一篇发表在国际杂志EbioMedicine上题为“Alterations of the gut mycobiome in patients with MS”的研究报告中,来自华盛顿大学医学院等机构的科学家们通过研究发现,摄入过多肉类或会让肠道中特定细菌的水平减少,且血液中特定的免疫细胞更多,而这些或许都与多发性硬化症的发生有关;文章汇总,研究者找出了一些微妙的关联,其或有望帮助理解疾病发生的原因。
如今,越来越多的研究证据表明,细菌或许参与了其中;生活在肠道中的细菌或会影响机体免疫系统的功能,而且我们所摄入的食物也会影响肠道中的细菌;为此研究者Yanjiao Zhou等人对49名志愿者(25名多发性硬化症和24名健康对照个体)进行研究,分析了其肠道微生物组、免疫系统、饮食和血液中代谢产物,旨在寻找其中的微妙但非常重要的关联。研究者Zhou说道,我们发现了很多肠道菌群或与多发性硬化症及多发性硬化症患者残疾的严重程度有关,而且多发性硬化症患者机体中自身免疫性标志物和标志性代谢物的水平会增加,但真正让研究人员感兴趣的是这些系统是如何进行连接的,以及饮食如何参与到这些连接中;利用多组学方法,研究人员试图关闭这个循环并揭示多个系统之间的关联。
本文研究中,研究人员首次利用一种综合性方法来分析饮食、肠道微生物组、免疫系统和代谢之间的相互作用对多发性硬化症的疾病进展和病理学表现中的贡献,同时本文研究或许为后期科学家们解决相关问题开辟了一种新的模式,即既不看单一的因素,也不看复杂的相互作用,这种方法或能帮助识别相关的网络,从而对其修饰用来进行疾病预防和治疗性措施的开发。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


