厦门大学团队发现热应激耐受产生的分子机制及其在食道癌发生发展中的作用
来源:科学网 2021-07-07 20:25
近日,厦门大学药学院Dieter A. Wolf教授课题组在国际著名分子生物学期刊EMBO Journal上发表题为“Dual roles of HSP70 chaperone HSPA1 in quality control of nascent and newly synthesized proteins”的研究论文,揭示了热应激过程中HSPA1和26S
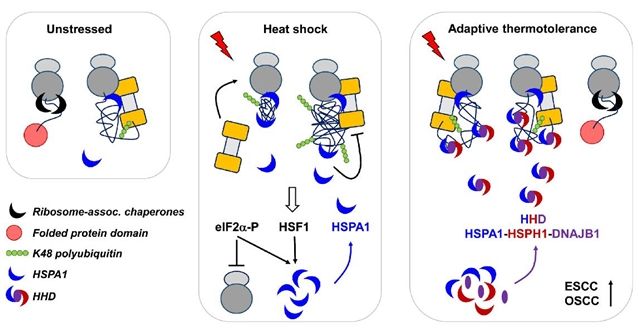
近日,厦门大学药学院Dieter A. Wolf教授课题组在国际著名分子生物学期刊EMBO Journal上发表题为“Dual roles of HSP70 chaperone HSPA1 in quality control of nascent and newly synthesized proteins”的研究论文,揭示了热应激过程中HSPA1和26S蛋白酶体(26S Proteasome)对新生肽链进行质量控制的机制,并在此基础上进一步阐明了细胞热应激耐受形成及HSPH1促进食道癌发生发展的分子机制。
当环境因素发生改变细胞会产生一系列的应激反应并诱导基因表达发生改变,以增强细胞对应激环境的适应能力。细胞发生热应激并恢复后会对二次热应激产生耐受,其产生耐受的机制尚不明确。
在该研究中,Dieter A. Wolf课题组研究人员首先通过热应激的方法建立细胞应激耐受模型,在此基础上进一步通过定量蛋白质质谱的方法,分析不同应激状态下细胞基因表达的变化,确定了热休克蛋白HSPA1及其辅因子HSPH1和DNAJB1大量诱导表达是细胞产生热应激耐受的主要因素。进一步研究发现HSPA1通过两种途径促进细胞产生热应激耐受:一是促进26S蛋白酶体招募至80S核糖体,提高26S蛋白酶体降解应激产生的受损新生肽链的速率,进而提高核糖体的翻译效率;二是在热应激耐受过程中,HSPA1与HSPH1通过维持受损新生肽链处于可溶解的状态,来提高其被26S蛋白酶体降解的速率。
在此基础上,研究人员对HSPA1和HSPH1基因在肿瘤细胞表达数据库(CCLE)进行检索,发现HSPH1在食道癌细胞中表达量最高,临床病理数据进一步表明HSPH1的高表达与食道癌及多种肿瘤的发生发展及不良预后有关。最后,研究团队通过Crisper/Cas9基因编辑的方法对食道癌细胞系KYSE150进行HSPH1基因敲除,并观察敲除HSPH1基因的食道癌细胞系在小鼠皮下移植瘤的增殖状况。结果显示与野生型细胞相比,HSPH1功能缺失的食道癌细胞系其在小鼠皮下肿瘤增殖速率显着减缓,证明了HSPH1可作为治疗食道癌的潜在靶点。
厦门大学药学院田贵游博士为该论文的第一作者,程亚彬助理教授和Dieter A. Wolf教授为共同通讯作者,讲座教授Wolfgang Dubiel、2017级博士生胡程和2018级硕士生云芸参与了该项目研究。特别感谢药学院分析仪器中心丁蓉老师对本项目的帮助。该研究工作获得了两项国家自然科学基金面上项目(81773771、31770813),两项福建省科技厅基金(13181196、2017J05138)的经费支持。(生物谷 bioon)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


