Nat Biotechnol:科学家利用“诱饵”欺骗抗体从而来预防移植细胞的排斥反应
来源:生物谷原创 2023-01-13 14:19
来自加州大学旧金山分校等机构的科学家们通过研究开发了一种新型有望挽救患者生命的方法,其或能防止抗体所诱发的对工程化治疗以及所移植细胞的免疫排斥反应。
用于癌症疗法或再生医学研究的异基因细胞疗法很容易受到抗体介导的杀伤性作用,这或许就会削弱其治疗效果。近日,一篇发表在国际杂志Nature Biotechnology上题为“Protection of cell therapeutics from antibody-mediated killing by CD64 overexpression”的研究报告中,来自加州大学旧金山分校等机构的科学家们通过研究开发了一种新型有望挽救患者生命的方法,其或能防止抗体所诱发的对工程化治疗以及所移植细胞的免疫排斥反应。
事实证明,由抗体所介导的排斥反应(与免疫细胞所开启的化学攻击作用相反)非常难以解决,这或许就是阻碍一些疗法发展的重要因素。这项研究中,研究人员利用一种“诱饵”受体来捕获抗体,并在其能杀灭治疗性细胞之前将其带出整个循环过程,因为其会将治疗性细胞视为外来入侵者,这一策略或许对于器官移植非常有用。医学博士Tobias Deuse说道,这种抗体所介导的排斥反应真的很难克服,因此,相比尝试抑制患者机体免疫系统的功能而言,研究人员寻找了很多改变细胞的方法,从而使得患者能够接受更好的治疗来得以生存。
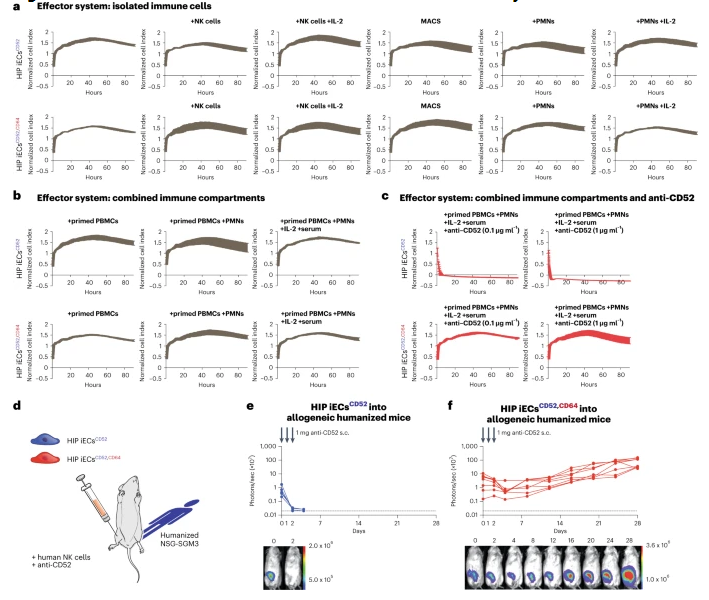
科学家利用“诱饵”欺骗抗体从而来预防移植细胞的排斥反应。
图片来源:Nature Biotechnology (2023). DOI:10.1038/s41587-022-01540-7.
在美国最著名的细胞疗法就是嵌合抗原受体(CAR)T细胞疗法,这种疗法通常能成功用来治疗特定形式的淋巴瘤(一类通常具有致死性的癌症),实际上,利用这种疗法来抵御实体瘤往往要更加困难。直到最近,大多数的CAR-T细胞疗法开始利用患者自身的细胞,但所有类型的细胞疗法的长期商业可行性往往依赖于“异体”细胞,即从患者机体以外的来源大量生产的治疗性细胞。
研究者Deuse指出,就好像移植器官一样,受体机体的免疫系统很可能会将任何外来细胞以及由这些细胞所长成的组织视为外来物,并对其产生一定的排斥作用;我们已经经历过器官移植,因此我们都知道对于细胞移植而言将来会发生什么?这个问题或许是任何类型的异体细胞移植都会面临的一个严重的障碍。异体的CAR-T细胞疗法的临床试验所得到的结果往往要比来自患者细胞的疗法所得到的的结果要差,而且相比所移植器官中的细胞而言,免疫疗法还需要面对这些自由漂浮的细胞受到免疫攻击的额外挑战。因此,研究人员就必须找到更好的方法来保护这些细胞;通常情况下,当一个抗体与细胞结合时,其就像一种标签一样能呼唤免疫细胞与抗体进行结合,并启动一种破坏被标记细胞的有效过程;为了阻断这种连锁反应,研究人员开发了一种方法,其能在抗体与细胞结合之前来对其进行捕捉,从而防止机体免疫反应的激活。研究人员对三类细胞进行遗传工程化修饰,包括产生胰岛素的胰腺胰岛细胞、甲状腺细胞和CAR-T细胞,以便每种类型的细胞都能在其表面制造并展示大量名为CD64的蛋白质。在这些工程细胞上,CD64能紧密结合负责这类免疫排斥反应的抗体,并能扮演“诱饵”的角色捕捉抗体并将其与工程化细胞所结合,以便其无法激活免疫细胞。
研究者Deuse说道,如今我们能够夺取这些高水平蛋白,从而就会促使治疗性细胞产生非常强大的保护力,而这或许就是这种方法的一种明确的概念性证明。在这种方法用于对设计成为治疗性细胞或移植细胞的细胞进行测试之前,科学家们还需要进行大量工作,尽管诸如此类细胞在生物学上具有一定的复杂性,但其也非常昂贵且难以治疗。研究者希望,这一概念能帮助开发普遍可用的异体细胞并推动其发展,这或许也能使得细胞疗法变得更加便宜且容易获取,从而让更多患者获益。
综上,本文研究结果表明,在研究人员所开发的新方法的三项应用中,人类CD64 T工程化甲状腺上皮细胞、胰腺β细胞和CAR-T细胞能耐受临床相关水平的移植物定向抗体,同时还能完全躲避抗体所介导的杀伤性效应。(生物谷Bioon.com)
原始出处:
Gravina, A., Tediashvili, G., Rajalingam, R. et al. Protection of cell therapeutics from antibody-mediated killing by CD64 overexpression. Nat Biotechnol (2023). doi:10.1038/s41587-022-01540-7
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


