Nature子刊:冯波团队实现低剂量AAV递送的CRISPR基因敲入,用于遗传病治疗
来源:生物世界 2022-12-02 13:25
研究团队系统研究了AAV-CRISPR介导的体内NHEJ基因敲入,实现了有效且更低和更安全剂量的AAV剂量,在成年和新生小鼠血友病B型模型中实现了有效的人源F9基因敲入,恢复了凝血因子Ⅸ的表达,从而恢
通过腺相关病毒(AAV)递送CRISPR基因编辑工具,为开发永久性逆转致病基因缺陷的疗法提供了巨大潜力。通过这种方式来靶向并敲入正常基因序列以恢复基因功能,而不用管突变类型,因此是一种很有吸引力的基因治疗策略。
然而,想实现AAV-CRISPR有效在体内细胞中的基因敲入,通常需要递送高剂量AAV,这会带来潜在安全风险,而且大大增加生产成本。
近日,香港中文大学冯波团队在 Nature Communications 期刊发表了题为:Low-dose AAV-CRISPR-mediated liver-specific knock-in restored hemostasis in neonatal hemophilia B mice with subtle antibody response 的研究论文。
研究团队系统研究了AAV-CRISPR介导的体内NHEJ基因敲入,实现了有效且更低和更安全剂量的AAV剂量,在成年和新生小鼠血友病B型模型中实现了有效的人源F9基因敲入,恢复了凝血因子Ⅸ的表达,从而恢复了血友病B型小鼠的凝血功能。
值得一提的是,在接受低剂量AAV-CRISPR的新生小鼠中,抗Cas9和抗AAV的血浆抗体几乎可以忽略不计,这为AAV-CRISPR介导的体细胞基因敲入治疗遗传性疾病提供了支持。

由凝血因子Ⅸ(由F9基因表达)突变引起的遗传性血友病B型被广泛用作疾病模型来研究基因敲入。通过同源定向修复(HDR)机制,使用AAV递送的锌指核酸酶(ZFN)在小鼠体内敲入人F9基因外显子(hF9 Ex2-8),使用AAV递送的CRISPR-SaCas9敲入小鼠mF9 Ex2-8和高活性hF9 R338L变体。
除了同源定向修复(HDR),DNA的另一种修复机制非同源末端连接(NHEJ)最近也被用于基因敲入,与HDR相比,基于NHEJ的基因敲入效率更高。由于无需同源序列,在进行体内基因编辑时,通过AAV递送供体序列进行NHEJ基因敲入具有潜力更大,也更具灵活性。
迄今为止,通过基于HDR或NHEJ的策略,AAV递送的体内基因敲入的效果已在临床前模型中得到广泛证实。然而,有效的体内基因敲入大多是以高剂量AAV为代价的,这会显著增加潜在安全风险和生产成本。
在这项研究中,研究团队在mAlb基因的3'UTR区域的新靶点进行了AAV-CRISPR介导的不依赖于同源序列的基因敲入。单剂AAV成功在成年和新生血友病B型小鼠中实现了人源F9基因的长期整合和表达,产生了高水平的人凝血因子因子Ⅸ(hFⅨ),并在整个48周的观察期间稳定地恢复凝血功能。
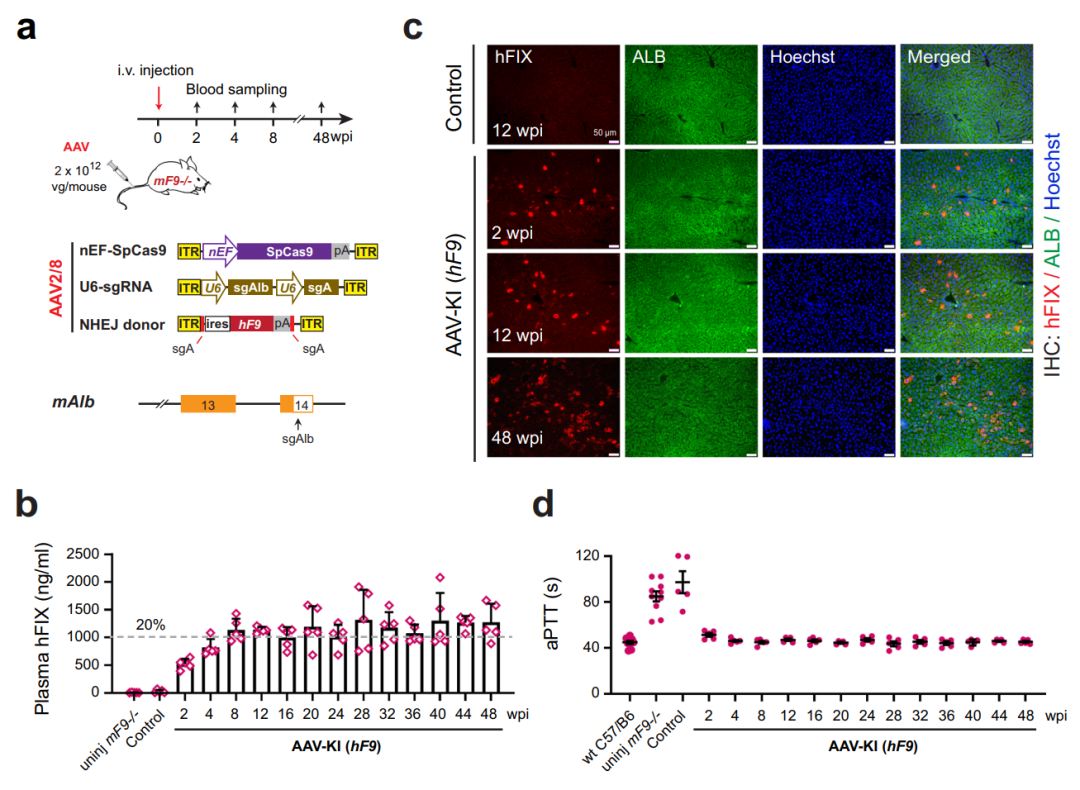
此外,研究团队通过使用高活性hF9 R338L 变体的肝脏特异性基因敲入,以显著降低的AAV剂量恢复了血友病B型小鼠的凝血功能(新生小鼠剂量为2×10E9 vg,成年小鼠为1×10E10 vg)。
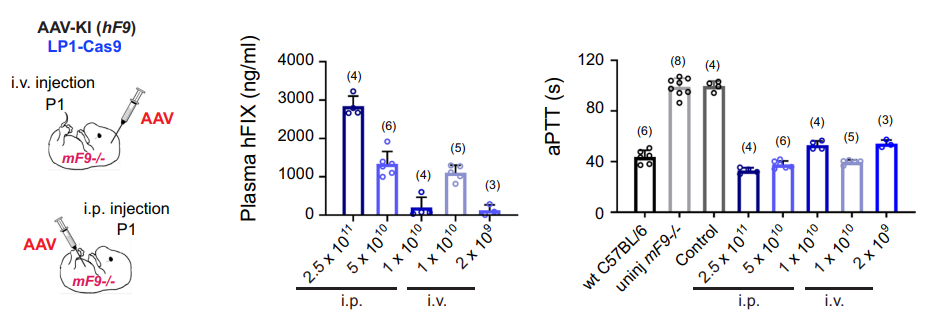
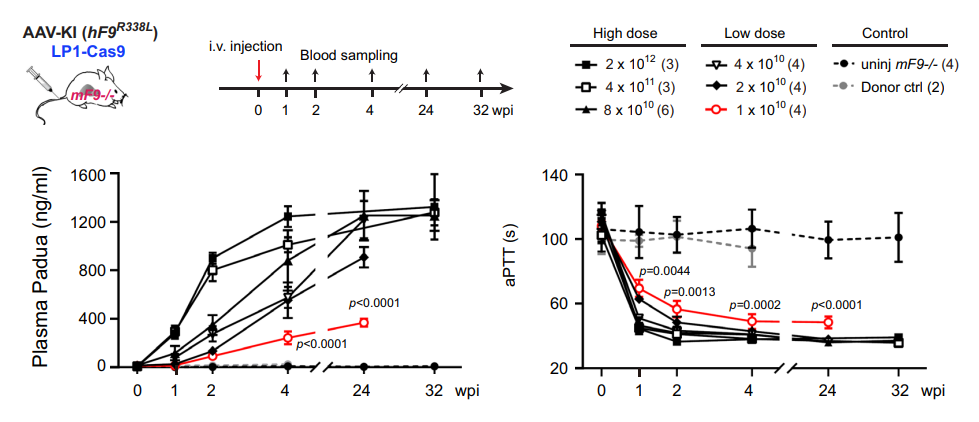
在接受低剂量AAV-CRISPR的新生小鼠中,抗Cas9和抗AAV的血浆抗体几乎可以忽略不计,这为AAV-CRISPR介导的体细胞基因敲入治疗遗传性疾病提供了支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


