Nature Biotechnology:从基因修复到基因不稳定性:AZD7648在基因组编辑中的巨大潜力与风险
来源:生物探索 2024-12-04 09:28
AZD7648作为一种HDR增强剂,在提高基因组编辑效率方面展现出了巨大的潜力,特别是在某些基因治疗的应用中,有望实现高效的基因校正。
随着基因组编辑技术的迅猛发展,尤其是CRISPR-Cas9系统的广泛应用,研究人员不仅在基础研究中取得了突破性进展,也为临床治疗带来了前所未有的可能性。基因组编辑技术使得我们能够精确地对基因组进行修改,修复有缺陷的基因,甚至替换致病突变,为治愈遗传性疾病和癌症等重大疾病提供了新的希望。然而,这项技术的应用并非没有代价,特别是当涉及到同源重组修复(HDR)时,其低效性一直制约着精准编辑的实现。HDR虽然能提供精准的基因修复,但在细胞中的修复效率远低于非同源末端连接(NHEJ),后者虽效率更高,却易产生基因组不稳定性,带来潜在风险。
近年来,DNA-PKcs抑制剂AZD7648作为一种提高HDR效率的创新药物引起了广泛关注。通过抑制DNA修复通路中的关键酶DNA-PKcs,AZD7648能够显著促进HDR修复过程,极大地提高了基因编辑的精准性和效率。这一发现为精准医学和基因治疗带来了新的希望,尤其是在需要精确基因替换的疾病治疗中,如遗传性疾病和某些类型的癌症。然而,这项技术的应用并非没有代价。
11月27日 Nature Biotechnology报道的研究“Genome editing with the HDR-enhancing DNA-PKcs inhibitor AZD7648 causes large-scale genomic alterations”,发现AZD7648的使用不仅提升了HDR效率,还可能引发一系列严重的基因组不稳定性,包括大规模基因缺失、染色体丢失和重排等。这些基因组变异可能对细胞的正常功能产生重大影响,甚至引发肿瘤等严重疾病。因此,在探索AZD7648及类似技术的临床应用时,我们必须谨慎权衡其提升编辑效率与可能引发的基因组不稳定性之间的风险。

AZD7648在基因组编辑中的作用与风险
近年来,基因组编辑技术,尤其是CRISPR-Cas9系统,给生命科学和医学带来了深刻变革。这种技术使得研究人员能够在特定基因位点引入DNA双链断裂,从而利用细胞内的修复机制进行精准的基因编辑。然而,DNA双链断裂(Double-Strand Break, DSB)可通过不同的修复机制来修复,其中主要包括非同源末端连接(Non-Homologous End Joining, NHEJ)和同源重组修复(Homology-Directed Repair, HDR)等。
通常情况下,NHEJ是一种高效但容易引入小插入或缺失(Indels)的修复途径,而HDR则利用外源DNA模板进行修复,可以实现精确的基因插入或替换。然而,HDR在人体细胞中的效率相对较低,往往无法满足基因治疗等临床应用的需求。因此,如何提高HDR效率成为了研究人员关注的重点。
AZD7648:一种提升HDR的创新手段
在这方面,一种名为AZD7648的DNA-PKcs抑制剂展示出了令人瞩目的潜力。DNA-PKcs(DNA-dependent protein kinase catalytic subunit)是NHEJ通路中的关键酶,抑制其活性可以抑制NHEJ的发生,进而促进HDR的进行。研究表明,AZD7648能够显著提高多种细胞类型中HDR的效率,使得HDR在基因编辑中的应用前景大大增强。
实验结果显示,在使用AZD7648处理K-562细胞和人类造血干细胞(HSPCs)时,HDR率显著提升。例如,在K-562细胞中,短读长测序(Short-read sequencing)显示,HDR比例达到了93%,而使用传统方法时,HDR比例只有约50%。类似地,在人类造血干细胞中,HDR事件也显著增加,显示出AZD7648在提高基因组编辑精确性方面的重要作用。
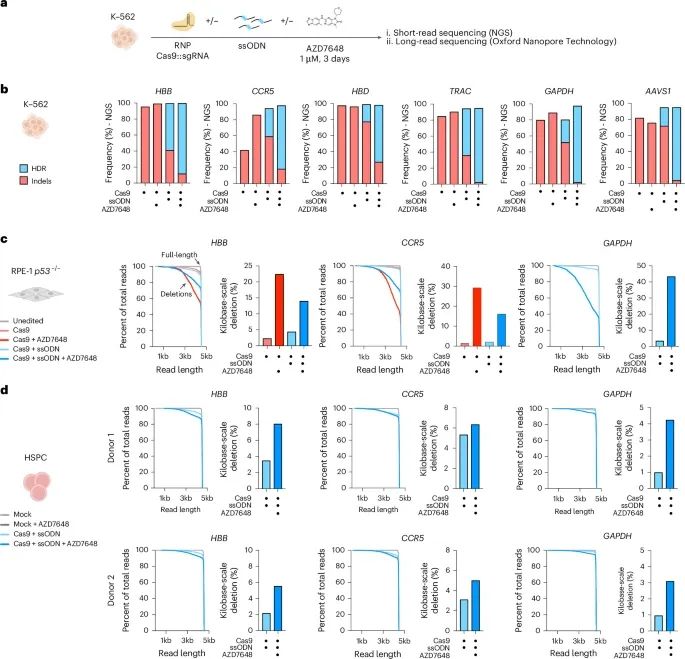
AZD7648在提高同源重组修复(HDR)效率方面的作用,以及它对基因组的影响,特别是大规模缺失的频率(Credit: Nature Biotechnology)
AZD7648的潜在风险:大规模基因组变异
尽管AZD7648提升了HDR效率,但研究发现,其在使用过程中可能引发严重的基因组不稳定性。这些基因组改动包括千碱基(kilobase, kb)级别的大规模缺失、染色体臂的丢失以及基因组重排等,这些大规模的变异往往难以通过常规的短读长测序检测到,导致编辑后基因组状态的潜在风险被低估。
为了更全面地了解AZD7648的影响,研究人员采用了长读长测序(Long-read sequencing)、数字PCR(Droplet Digital PCR, ddPCR)以及单细胞RNA测序(scRNA-seq)等技术进行检测。例如,在RPE-1 p53−/−细胞中,使用AZD7648进行基因编辑后,千碱基级别的大规模缺失事件从未处理时的7.5%增加到14.7%,且在多种细胞背景中,缺失事件的发生率提升了2至35倍。在HSPCs中,长读长测序显示在某些靶基因位点,大规模缺失的发生率从10%上升到43.3%。
此外,在一些细胞系中(如K-562细胞),研究人员还发现,AZD7648的处理可能导致整条染色体臂的丢失。例如,在K-562细胞中,使用数字PCR检测表明,AZD7648处理后染色体12的臂丢失发生率达到了20%以上。这种染色体大规模丢失对于基因组的完整性和细胞的正常功能可能具有严重的负面影响,可能导致细胞功能失常甚至细胞死亡。
为什么AZD7648会引起大规模变异?
AZD7648通过抑制NHEJ促进HDR,但它并非选择性地只增强HDR而忽略其他潜在影响。AZD7648的使用会抑制DNA-PKcs这一关键修复酶的活性,而DNA-PKcs不仅仅在NHEJ中发挥作用,它还在整个DNA损伤修复网络中具有重要作用。对DNA-PKcs的抑制可能使得细胞丧失处理某些大规模断裂或结构异常的能力,进而引发大规模的基因组改动,例如染色体臂丢失或重排等。
研究人员还发现,当AZD7648与其他编辑因子联合使用时,如在抑制Polθ的情况下,虽然能够部分减少大规模缺失的发生,但对染色体臂的丢失等问题改善不大,这表明AZD7648引发的大规模基因组变异是多因素协同作用的结果。
从单基因位点到全基因组的影响
为了进一步评估AZD7648的广泛影响,研究人员对多个细胞系进行了实验。在K-562细胞中,通过荧光蛋白(eGFP)报告系统,研究人员观察到,当对eGFP位点进行基因编辑时,AZD7648处理的细胞中,荧光蛋白的表达显著减少,这提示可能发生了与染色体重排或大片段缺失相关的现象。进一步的分析显示,AZD7648的处理可能导致整个染色体臂的丢失,从而使细胞丧失了相关基因的表达。
类似地,在造血干细胞和上呼吸道类器官中,研究人员也观察到了AZD7648导致的染色体大规模缺失现象。单细胞RNA测序(Single-cell RNA sequencing, scRNA-seq)结果显示,这些细胞中某些染色体区域的基因表达显著降低,进一步验证了染色体丢失的可能性。在上呼吸道类器官中,约47.8%的细胞表现出染色体臂的缺失,而在HSPCs中,这一比例为22.5%。
临床应用的谨慎考量
尽管AZD7648在提高HDR效率方面表现出显著优势,但其带来的大规模基因组不稳定性引发了广泛关注。在基因治疗等需要高精度和高安全性的应用场景中,这些潜在的大规模基因组变异可能带来无法预料的后果。因此,在将AZD7648应用于临床之前,必须对其可能带来的所有基因组层面的影响进行全面评估。
例如,在某些情况下,大规模的基因缺失或重排可能影响基因组中其他关键基因的表达,进而引发细胞功能紊乱甚至肿瘤形成。任何可能的基因组不稳定性都会带来长期的风险。这些都要求研究人员在临床应用中要极为谨慎,需采取多层次的检测手段,确保基因编辑的安全性和可控性。
优化基因编辑策略
如何在提高HDR效率的同时,尽量避免不必要的基因组改动,是基因编辑领域的重要研究方向之一。研究人员已经在探索多种可能的解决方案。例如,将AZD7648与其他修复途径抑制剂如PolQi2结合使用,尽管对于一些大规模缺失的减少效果有限,但这类组合治疗策略为实现更安全有效的基因编辑提供了一个潜在的方向。
此外,进一步优化Cas9蛋白和向导RNA(gRNA)的设计,尽量减少非目标位点的切割和基因组的损伤,也是提高基因编辑安全性的有效手段。同时,发展更为精准的基因编辑工具,如基于碱基编辑(Base Editing)或先导编辑(Prime Editing)等新技术,从根本上减少大规模基因组改动的风险。
AZD7648作为一种HDR增强剂,在提高基因组编辑效率方面展现出了巨大的潜力,特别是在某些基因治疗的应用中,有望实现高效的基因校正。然而,其带来的大规模基因组改动如染色体缺失和重排等风险也不容忽视。在实际应用中,如何平衡编辑效率与安全性是一个关键问题,只有通过更加深入和全面的研究,才能确保基因编辑技术在医学和生命科学中的安全应用。
参考文献:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


