研究揭示蛋白质翻译调控衰老新机制
来源:广州健康院 2024-07-14 09:35
该研究揭示了m7G修饰调控衰老进程这一新的生理功能,发现了新的引起衰老相关的蛋白稳态失衡的上游信号途径。上述成果为健康衰老的干预策略提供了新的可能途径。
近日,中国科学院广州生物医药与健康研究院王涛课题组与王杰课题组,在《自然-通讯》(Nature Communications)上发表了题为Perturbation of METTL1-mediated tRNA N7- methylguanosine modification induces senescence and aging的研究成果。该研究揭示了METTL1/WDR4介导的tRNA-m7G修饰对于维持衰老过程中蛋白质组稳态的重要作用,并阐明了tRNA修饰对于衰老的调控作用。
蛋白稳态失衡是衰老的重要特征,表现为蛋白质非正常折叠和异常聚集。衰老过程中,多个因素共同作用导致蛋白稳态失衡。一方面,衰老导致蛋白发生翻译异常,包括错误氨基酸掺入、异常折叠和不完整蛋白随着衰老进程逐渐积累;另一方面,细胞的大分子自噬体系水平或功能降低,致使异常蛋白质不能及时清除而积累。这两方面因素共同作用而引起细胞蛋白质组发生改变,进而诱导衰老发生。有研究发现,增强自噬的策略如抑制mTORC1活性、节食和运动均能够延缓模式动物的寿命。然而,在衰老过程中,蛋白质翻译异常发生的原因尚不清楚。
该研究发现METTL1/WDR4不仅在三种衰老细胞模型而且在衰老的小鼠肝肾等组织中表达水平下调。FlucDM-GFP报告蛋白分析和衰老相关分析结果表明,敲降或敲除METTL1增加非正常折叠蛋白的聚集,加速细胞衰老;维持METTL1的表达则减少蛋白的聚集,延缓衰老进程。全身性可诱导敲除Mettl1加速小鼠衰老进程,其寿命只有6个月;过表达Mettl1可以促进顺铂-阿霉素诱导的肝肾损伤的修复。
机制研究表明,衰老伴随的RNA尤其是tRNA的m7G修饰水平降低,导致一部分tRNA进入RTD途径加速降解从而引起tRNA的供给不足,致使核糖体长时间停滞于mRNA对应的密码子位置,并激活整合应激反应和核糖体毒性应激反应。前者通过磷酸化eIF2α抑制细胞全局蛋白质合成的起始,后者通过磷酸化p38上调SASP炎症因子分泌。此外,细胞周期蛋白和Wnt信号通路的蛋白质在翻译水平被抑制。两方面的因素共同促进衰老发生。该研究验证了转录因子sp1对于Mettl1和Wdr4的转录调控作用。衰老进程中sp1降低,可能是m7G修饰复合物下调的重要调控因素。
该研究揭示了m7G修饰调控衰老进程这一新的生理功能,发现了新的引起衰老相关的蛋白稳态失衡的上游信号途径。上述成果为健康衰老的干预策略提供了新的可能途径。
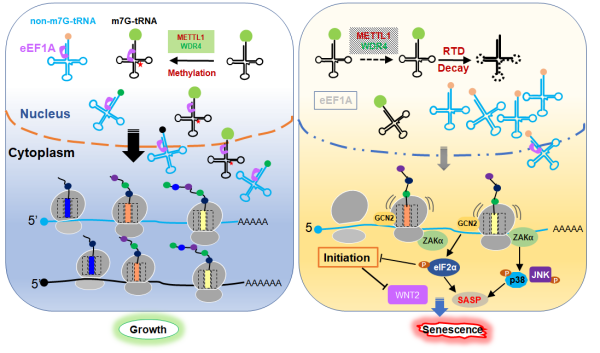
研究揭示METTL1介导的tRNA修饰调控衰老的作用模式
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


