渤健药物氨吡啶缓释片获批用于改善多发性硬化成年患者的步行能力
2021年5月14日,渤健公司今日宣布,氨吡啶缓释片正式获得国家药品监督管理局批准,用于改善多发性硬化(以下简称MS)合并步行障碍(EDSS评分4-7分)成年患者的步行能力。氨吡啶缓释片是中国首个获批的能够改善MS成人患者步行能力的治疗方法。氨吡啶缓释片位列第一批临床急需境外新药名单,其新药上市申请于2021年1月被国家药品监督管理局受理,并于2021年4月被纳入了优先审评审批程序。
北京病痛挑战公益基金会携手诺华制药联合发布全国首部多发性硬化患者纪录片《让爱可及》
2021年2月28日,2021年国际罕见病日,北京病痛挑战公益基金会携手诺华制药(中国)联合发布我国首部多发性硬化患者纪录片《让爱可及》。短片讲述了多发性硬化患者瑶瑶(化名)整个就诊、确诊、治疗的历程,确诊前四处奔波,找不到病因的无奈;确诊后的无助和绝望;以及在家人和病友的支持下重拾信心,积极投身患者组织,为更多病友呼吁呐喊。纪录片真实展示了多发
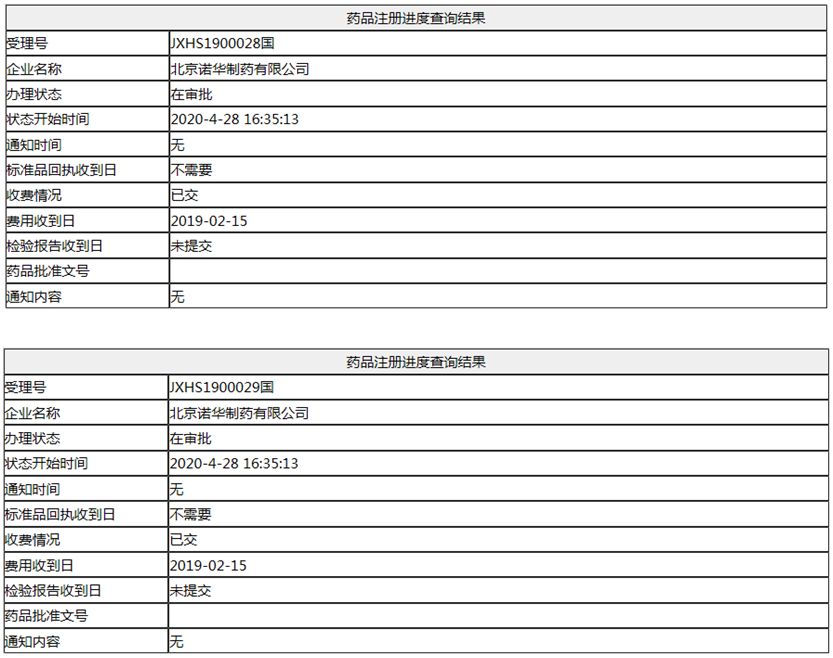
仅比美国晚一年 诺华多发性硬化症药「西尼莫德片」即将国内获批
近日,诺华西尼莫德片的上市申请(受理号:JXHS1900028、29)已经变更为"在审批",预计近期获批上市。西尼莫德是用于治疗多发性硬化症的药物,2019年3月获FDA批准上市,2019年7月,诺华的另一个MS重磅药芬戈莫德国内上市。2019年3月获FDA批准西尼莫德(Siponimod、商品名:Mayzent)是诺华开发的新一代选择性1-磷酸鞘氨醇(S1
默克Mavenclad(克拉屈滨片)获美国FDA批准,治疗2类多发性硬化症
2019年03月30日讯 /生物谷BIOON/ --德国默克(Merck KGaA)近日宣布,美国食品和药物管理局(FDA)已批准Mavenclad(cladribine,克拉屈滨片剂),用于复发缓解型多发性硬化症(RRMS)和活动性继发进展型多发性硬化症(SPMS)成人患者的治疗。Mavenclad是首个也是唯一一个获FDA批准、在2年内最多口服20天即可提供2年疗效的口服多发性硬化症(MS)药
默克Mavenclad(克拉屈滨片)获批治疗复发缓解型多发性硬化症(RRMS)
2019年3月27日讯 /生物谷BIOON/ --德国默克(Merck KGaA)近日宣布,Mavenclad(cladribine,克拉屈滨片剂)获瑞士医疗产品管理局(Swissmedic)批准,治疗高度活跃的复发缓解型多发性硬化症(RRMS)。Mavenclad是首个在2年内最多口服20天可提供长达4年疾病控制的RRMS药物。默克生物制药业务全球研发主管Luciano Rossetti表示,“