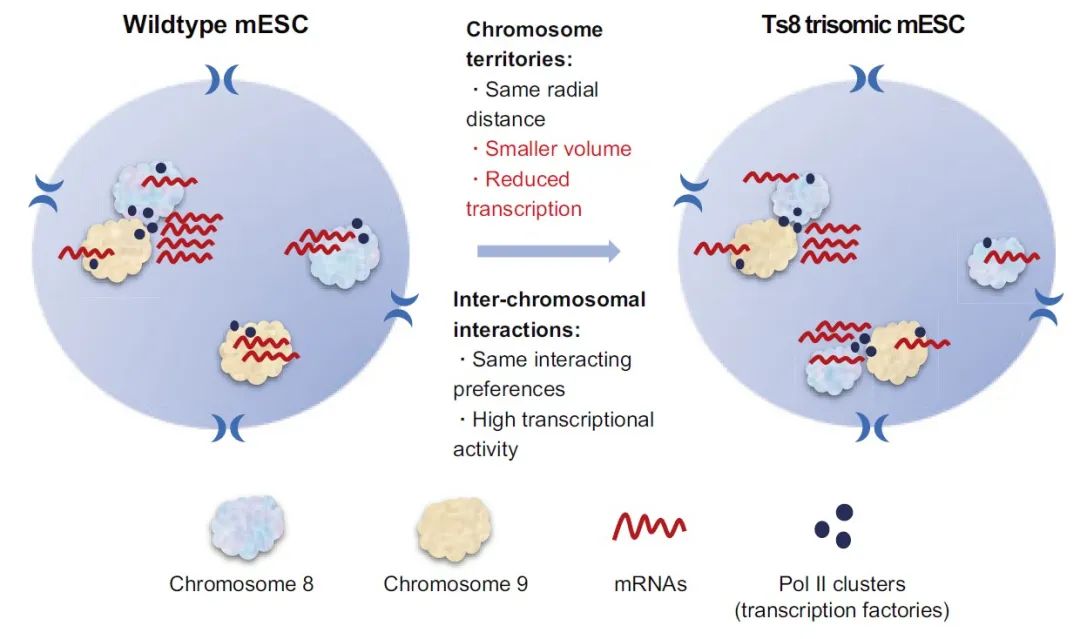
李程/孙育杰/黄粤团队揭示异倍体对染色质空间结构和转录组的影响
本研究结合Hi-C、RNA-seq、染色体成像和新生RNA成像技术,探究了异倍体ESC相比正常二倍体ESC在染色质三维结构和基因转录层面的变化。
2024-04-12
Nature子刊:黄荷凤院士团队揭示FSH调节胰岛素分泌和糖稳态新机制
该研究首次报道了在人和小鼠胰岛β细胞中表达FSHR,FSH结合FSHR,通过cAMP-PKA和胞内钙信号,调控葡萄糖刺激胰岛素分泌。
2023-11-06
Nature子刊:黄波/张晓辉/张毅合作团队解开肿瘤患者贫血和血小板增多之谜
AhR作为肿瘤免疫中的一个关键分子,针对AhR的多个抑制剂正在进行临床试验。这项研究工作对于AhR是导致肿瘤相关贫血和血小板增多的关键因素的机制阐明,具有重要理论意义和临床价值
2023-11-04
ACS Nano:南京师范大学黄和/李亚楠团队开发生物酶纳米制剂,提高乳腺癌“饥饿疗法”效果
该研究提出了一种新型靶向治疗策略,通过仿生纳米药物靶向耦联调节因子的互补式代谢网络,克服乳腺癌的代谢可塑性,提高饥饿疗法的治疗效果。
2024-02-01
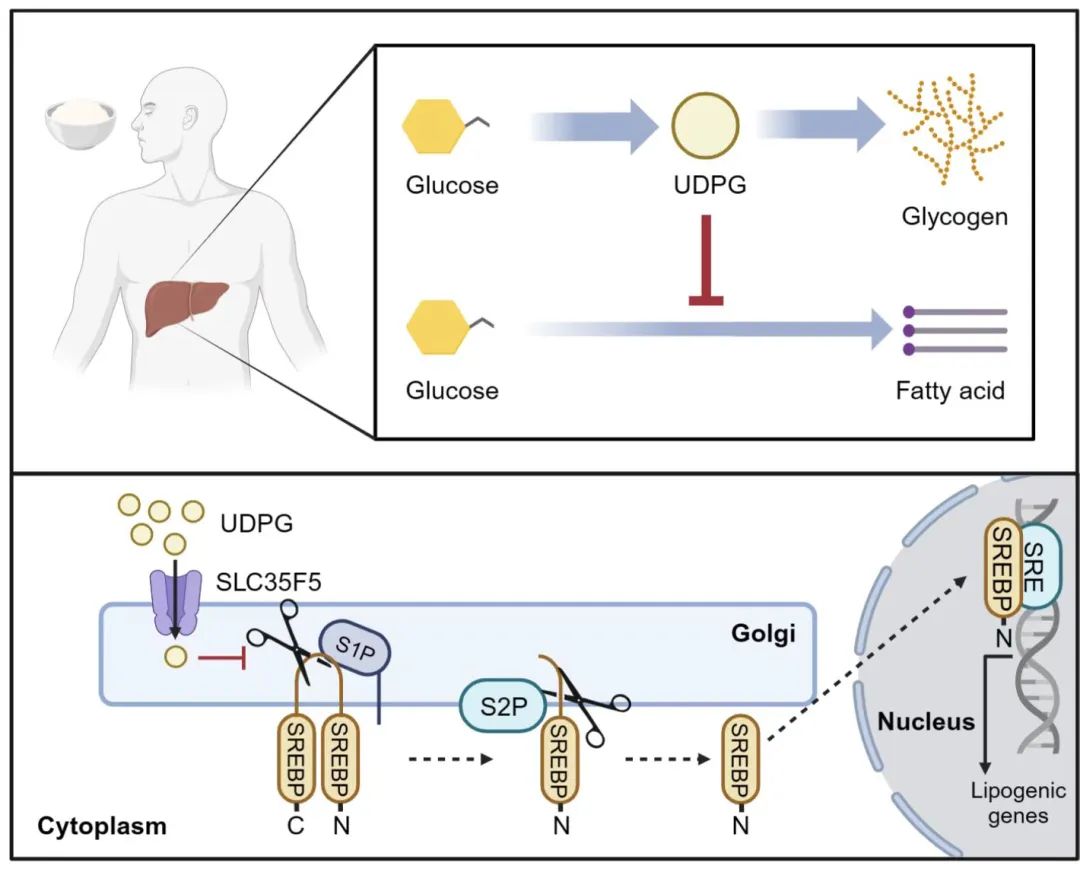
黄波团队发表Science论文,揭开肝脏能量储存的优先级与机制
在肝脏细胞中,糖原合成的中间代谢物UDPG可以促进S1P蛋白酶的活性,阻止SREBP的切割活化,从而抑制脂肪酸的从头合成。
2024-02-18
汕头大学黄承扬团队揭示表观遗传调控因子驱动干细胞衰老的关键机制
转录和表观遗传失调损害大脑老化过程中增殖性神经干细胞/祖细胞(NSPC)的产生,揭示了驱动干细胞衰老的关键内在机制,并确定了可能恢复衰老干细胞功能的潜在靶点。
2024-01-08
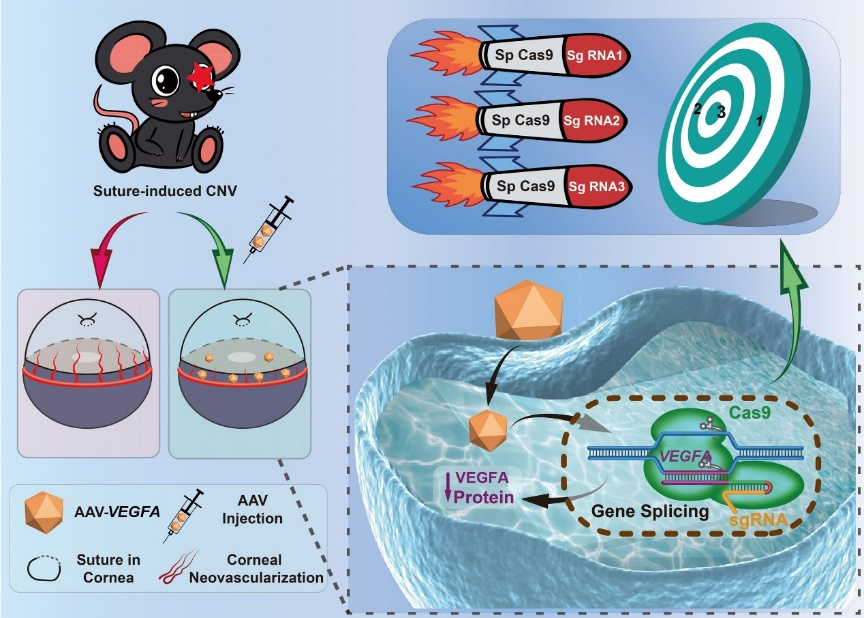
Adv Sci:黄锦海/周行涛团队使用AAV介导的CRISPR基因编辑治疗角膜新生血管
该研究使用CRISPR-Cas9基因编辑系统敲除VEGFA基因来治疗小鼠缝线诱导的角膜新生血管。据悉,这是第一项利用AAV介导的CRISPR-Cas9基因编辑系统在体内治疗角膜新生血管的研究。
2024-04-15
Conagen开发视黄醇衍生物成分,稳定性、控释和功能再升级,预计2024年商业化
今年以来,Conagen 已先后宣布实现帝国染料“骨螺紫”的首次商业化,以及与 Natáur 合作生产可持续天然牛磺酸。
2023-08-28