首创NHE3抑制剂Xphozah获美国FDA专家委员会支持,复星医药引进中国!
tenapanor是治疗慢性肾脏病(CKD)透析患者高磷血症的一种首创药物,复星医药于2017年12月获得了中国独家授权。
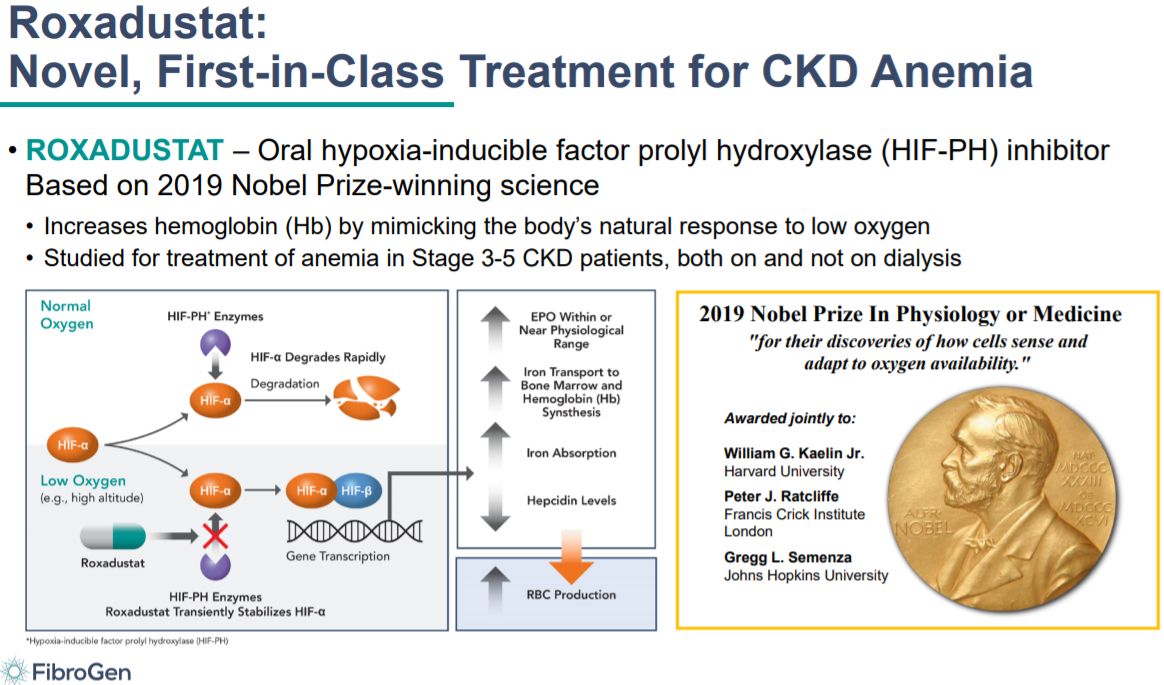
FDA专家委员会反对批准罗沙司他上市
7月15日,美国FDA心血管和肾脏药物咨询委员会(CRDAC)投票反对批准珐博进/阿斯利康开发的口服HIF-PH抑制剂罗沙司他(Roxadustat)用于治疗慢性肾病贫血患者的上市申请,其中针对透析CKD贫血患者的投票结果为12:2,针对非透析CKD贫血患者的投票结果为13:1。该委员会的投票是基于一项包括8000多例患者的全球性III期临床项目数据。罗沙司
阿诺医药宣布成立新一届科学顾问委员会,全球顶尖专家助力药物研发进程
2021年3月8日,临床阶段的全球性生物制药公司阿诺医药今日宣布成立新一届科学顾问委员会(SAB, Scientific Advisory Board),聘请五位享誉全球的专家成为阿诺医药科学顾问委员会的成员。
舒泰神BDB-001注射液治疗新冠肺炎的临床试验获得伦理委员会批准
2月21日,舒泰神发布公告称,公司及全资子公司德丰瑞研发的关于BDB-001注射液治疗新冠肺炎的Ib期临床试验已获得海南省第三人民医院伦理委员会批准,完成准备工作,即将开展上述临床试验。资料显示,在H1N1感染小鼠、H5N1感染小鼠、H7N9感染非洲绿猴等研究中,发现补体系统过度激活,具体表现为C3、C5a、C5b-9、MBL-c等补体系统相关分
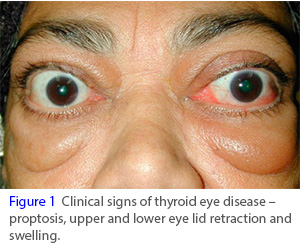
Horizon公司IGF-1R靶向单抗teprotumumab获美国FDA专家委员会全票通过!
2019年12月29日讯 /生物谷BIOON/ --Horizon Pharma是一家专注于开发和商业化创新药物以满足罕见疾病和风湿性疾病领域治疗需求的制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)皮肤科和眼科药物咨询委员会(DODAC)以全票通过、一致支持了teprotumumab治疗活动性甲状腺眼病(TED)的潜在益处大于风险。目前,tepr
首创EZH2抑制剂tazemetostat治疗上皮样肉瘤获美国FDA专家委员会全票通过!
2019年12月20日/生物谷BIOON/--Epizyme是一家临床阶段的美国生物制药公司,致力于开发创新性的表观遗传学药物来改写癌症及其他严重疾病的治疗。近日,该公司宣布,美国食品和药物管理局(FDA)肿瘤药物顾问委员会(ODAC)以11票对0票的投票结果,支持了tazemetostat作为一种药物治疗转移性或局部晚期上皮样肉瘤(ES)患者的利益-风险比
阿斯利康/默沙东Lynparza(利普卓)治疗gBRCAm胰腺癌获美国FDA专家委员会支持!
2019年12月19日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)与合作伙伴默沙东(Merck & Co)近日联合宣布,美国食品和药物管理局(FDA)肿瘤药物顾问委员会(ODAC)以7票对5票的投票结果,建议批准靶向抗癌药Lynparza(中文品牌名:利普卓,通用名:olaparib,奥拉帕利),作为一线维持单药疗法,治疗接受一线
默沙东Keytruda(可瑞达)新适应症获美国FDA专家委员会推荐批准!
2019年12月19日讯 /生物谷BIOON/ --肿瘤免疫治疗巨头默沙东(Merck & Co)近日宣布,美国食品和药物管理局(FDA)肿瘤药物顾问委员会(ODAC)以9票对4票的投票结果,建议批准抗PD-1疗法Keytruda(中文商品名:可瑞达,通用名:pembrolizumab,帕博利珠单抗)用于某些高危肌肉浸润性前列腺癌(NMIBC)患者的
基因编辑婴儿诞生后 中国批准设立伦理咨询委员会
在首例基因编辑婴儿诞生引发全球争议近一年之后,中国将设立一个国家委员会就科研伦理监管向政府提供建议。根据中国媒体的报道,国家发改委上个月底批准了建立委员会的计划,委员会如何工作政府没有披露多少细节。但社科院生物伦理学家 Qiu Renzong 表示它将能减少不同部委之间生物伦理监管的碎片化,识别监管执行中的漏洞,建议政府对违反规定的人采取合适的惩罚。中国青年报本周早些时候发表文章称,“有研究人员认