三阴性乳腺癌(TNBC)重磅新药!吉利德/云顶新耀Trodelvy(戈沙妥组单抗) 中国2b期研究成功:ORR达38.8%!
来源:本站原创 2021-11-12 01:46
Trodelvy是第一个显著延长TNBC患者总生存期(OS)的药物。在中国,Trodelvy上市申请已被纳入优先审评。
2021年11月11日讯 /生物谷BIOON/ --吉利德科学(Gilead)近日宣布,在合作伙伴云顶新耀(Everest Medicines)赞助的2b期EVER-132-001研究中,靶向抗癌药Trodelvy(sacituzumab govitecan-hziy,戈沙妥组单抗)治疗转移性三阴性乳腺癌(mTNBC)达到了总缓解率(ORR)主要终点。
TNBC是最具侵袭性的乳腺癌,约占所有乳腺癌的15%,在年轻和绝经前女性中更为常见。TNBC特指雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体2(HER-2)三者均为阴性表达的乳腺癌。与其他类型的乳腺癌相比,TNBC的有效治疗方案极其有限。TNBC转移复发的平均时间为2.6年,而其他乳腺癌为5年。在转移性TNBC患者中,5年生存率为12%,而其他类型转移性乳腺癌患者的5年生存率为28%。
Trodelvy是一款靶向Trop-2的新型首创(first-in-class)抗体偶联药物(ADC),Trop-2是一种位于细胞表面的蛋白质,在TNBC和许多其他肿瘤中过度表达。截至目前,Trodelvy已在美国、瑞士、英国、澳大利亚、加拿大获得批准,用于治疗TNBC。此外,通过许可合作伙伴云顶新耀,Trodelvy也正在接受中国和新加坡的监管审查。
EVER-132-001是一项单臂、多中心2b期注册研究,正在评估Trodelvy治疗TNBC的疗效和安全性。该研究在中国入组了80例不可切除性局部晚期或转移性TNBC患者,这些患者既往接受过至少2种系统治疗,其中至少一种用于治疗转移性疾病。主要终点为总缓解率(ORR),由独立审评委员会(IRC)根据实体瘤疗效评价标准1.1版(RECIST v1.1)进行评估。结果显示,经IRC评估确定的总缓解率(ORR)为38.8%(CI:95%)。Trodelvy的安全性特征与先前研究中报告的相似,未发现新的安全信号。该研究的ORR结果与全球3期ASCENT(NCT02574455)研究的结果(ORR=35%)一致。
值得一提的是,Trodelvy是第一个在治疗转移性TNBC方面显示优于标准护理的疗法,标志着TNBC治疗方面的一个重大进步。在全球3期ASCENT研究中,与化疗相比,Trodelvy显著延长了疾病无进展生存期(中位PFS:4.8个月 vs 1.7个月、将疾病恶化或死亡风险显著降低57%(HR=0.43,p<0.0001),无论是否存在脑转移。此外,与化疗相比,Trodelvy显著延长了总生存期(中位OS:11.8个月 vs 6.9个月)、将死亡风险显著降低49%(HR=0.51,p<0.0001)。此外,Trodelvy组与化疗组相比ORR也显著提高(35% vs 5%)。
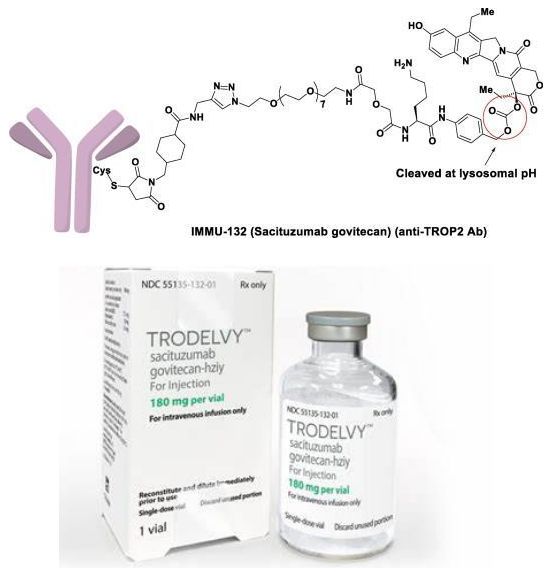
Trodelvy结构特征(图片来源:broadpharm.com)
Trodelvy是一款靶向Trop-2的新型、首创的抗体偶联药物(ADC),由靶向TROP-2抗原的人源化IgG1抗体与化疗药物伊立替康(一种拓扑异构酶I抑制剂)的代谢活性产物SN-38偶联而成,药物-抗体比高达7.6:1。Trop-2是一种在许多上皮性肿瘤(包括TNBC)中频繁表达的细胞表面蛋白,在90%以上的TNBC中表达。Trodelvy与Trop-2靶向结合并递送抗癌制剂SN-38来杀死癌细胞。
Trodelvy由Immunomedics公司开发,其专有ADC平台的核心是使用一种新型的链接子,这种链接子不需要酶来释放有效荷载,可在肿瘤细胞内和肿瘤微环境中递送活性药物,从而产生近旁效应(bystander effect)。2019年4月,云顶新耀(Everest Medicines)与Immunomedics签订协议,获得了Trodelvy在大中华区、韩国、蒙古国、东南亚国家和地区的权益。2020年9月,吉利德以210亿美元收购Immunomedics,将Trodelvy收入囊中。
在美国,Trodelvy已获批2项适应症:(1)用于治疗先前已接受过至少2种疗法、其中至少1种疗法治疗转移性疾病的不可切除性局部晚期或转移性TNBC成人患者;(2)用于治疗先前接受过含铂化疗、以及PD-1抑制剂或PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌(UC)成人患者。
在中国,Trodelvy(戈沙妥组单抗)于2020年10月被纳入到2020版《中国晚期乳腺癌规范诊疗指南》,该指南由国家肿瘤质控中心乳腺癌专家委员会、中国抗癌协会乳腺癌专业委员会、中国抗癌协会肿瘤药物临床研究专业委员会共同编撰。2021年5月,国家药监局(NMPA)受理Trodelvy的生物制品上市许可申请,并将其纳入优先审评:用于治疗接受过至少2种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除的局部晚期或转移性TNBC成人患者。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->



