《自然》:抗癌能用的新抗原,比我们想的多多了!
来源:奇点糕 2022-08-23 13:33
肿瘤的发生发展通常意味着局部组织的一些异常变化,比如复杂的基因突变,非自身蛋白的表达或自身蛋白的异常表达等。
肿瘤的发生发展通常意味着局部组织的一些异常变化,比如复杂的基因突变,非自身蛋白的表达或自身蛋白的异常表达等。
类似病毒感染后细胞中的外来肽,肿瘤细胞也会将突变产生的新抗原通过MHC-I呈递,这导致它们被CD8+T细胞识别,驱动抗肿瘤免疫反应[1]发生。如果把所有由MHC-I所呈递的肽放在一起,它们通常被统称为免疫肽组[2]。
目前,肿瘤免疫治疗的关注度非常高,例如免疫检查点抑制剂、免疫细胞过继治疗、新抗原疫苗等,MHC-I抗原呈递的效率被证明能一定程度上解释疗效[3,4];筛选或预测这些新抗原,将有助于肿瘤免疫疗法的开发。
实际上,许多蛋白质组学、免疫学实验方法已被用于发现新抗原,但均仅限于体外研究或使用混合的肿瘤裂解物,并且缺乏肿瘤微环境或组织特异性刺激。因此,之前的研究并不能反应肿瘤免疫肽组的全貌。
近日,来自麻省理工学院的Tyler Jacks团队,使用基因工程小鼠模型(GEMMs)在体内研究肿瘤免疫肽组,试图揭示体内肿瘤抗原呈递的特征。
他们构建了一种可以在体内实现纯化细胞特异性pMHC(peptide-MHC)的模式小鼠。通过这一工具,他们发现在肿瘤进化过程中,癌症免疫肽组的细胞特性丧失,且癌症特异性抗原的呈递并非由该抗原RNA的丰度或翻译效率所驱动。
此外,他们还鉴定了在肺腺癌(LUAD)细胞上呈递的免疫原性表位,证明了癌症中可靶向抗原的范围可能比目前所知的更为广泛。这一研究成果发表在《自然》杂志上[5]。

文章首页截图
为了构建上文提到的模式小鼠,Jacks团队构造了一个Cre重组酶诱导的、编码高度特异性亲和力标签StrepTagII(该标签将用于MHC-I复合物的亲和力纯化)的外显子,该外显子位于H2-K1的1号内含子中(KbStrep)。
随后,他们将KbStrep等位基因敲入携带KrasLSL-G12D/+Trp53fl/fl(KP)基因型小鼠的胚胎干细胞中。如此一来,在Cre重组酶腺病毒诱导StrepTagII表达后,就能从模式小鼠体内纯化肿瘤特异性MHC-I复合物(图2a-b)。
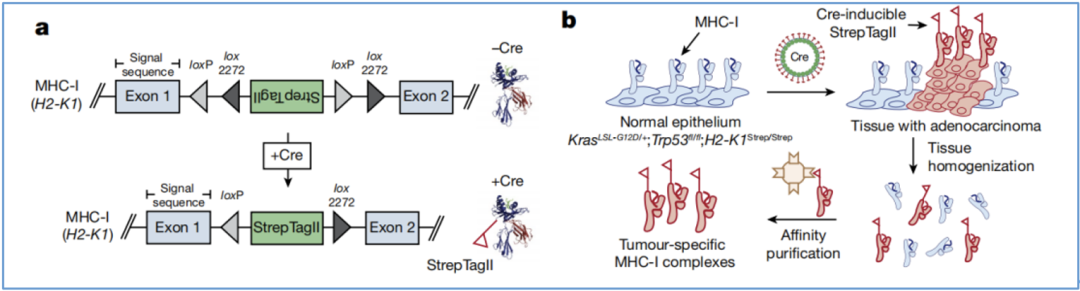
图2 KP/KbStrep小鼠模型的设计
为了检验这一模型的有效性,Jacks团队将KP/KbStrep模型应用于原位LUAD(图3c),证明确实可以进行特异性较高、覆盖度较深的免疫肽组分析。
基于抗体的免疫沉淀法分离,他们得到了来自健康肺或16周荷瘤肺的H2-Kb肽;基于肿瘤细胞特异性亲和力纯化,他们则得到了来自16周KP/KbStrep类型(有亲和力标签)肿瘤以及KP/KbWT类型(无亲和力标签)肿瘤的肽(图3d)。
其中,除了KP/KbWT肿瘤样本,其他样本中获得的肽段均具有一定的长度分布、预测的亲和力和反映Kb结合的氨基酸基序,且来自KP/KbStrep肿瘤样本的肽段具有更高的特异性(图3e-h)。
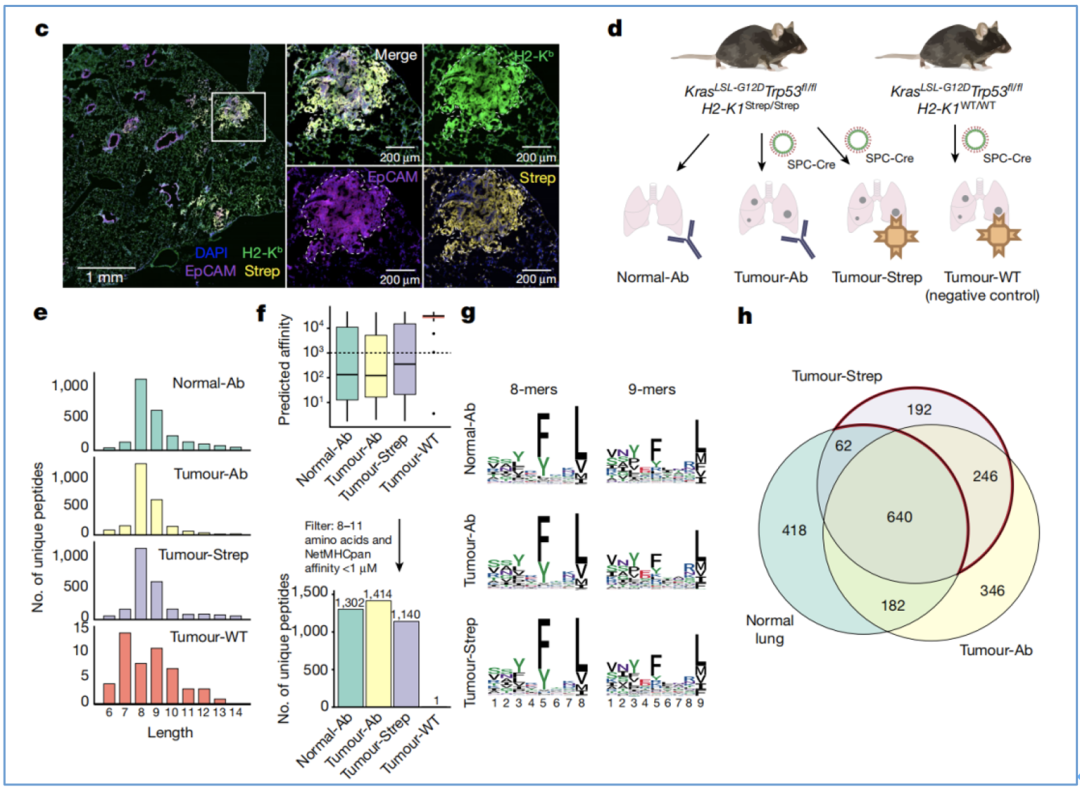
图3 KP/KbStrep小鼠模型的验证
为了更进一步探索通过亲和纯化分离得到的免疫肽组是否具有较高的细胞特异性,研究者们结合小鼠健康肺的scRNA-seq数据(用于将免疫肽组信息定位至相应细胞表型),比较了来自健康肺(Normal)、荷瘤肺(Ab)或表达Strep的癌细胞(Strep)中的肽(图4a)。
他们发现,Strep中肺泡2型(AT2)细胞表型显著富集(图4b),说明肿瘤特异性免疫肽主要来源于AT2细胞,该结果可解释为由AT2细胞特异性SPC启动子表达的Cre重组酶驱动了肿瘤起始(图3d)。
此外,他们还借助杂交手段获得了SftpccreERT2H2-K1Strep/Strep小鼠模型,该模型可通过三苯氧胺诱导StrepTagII特异性掺入健康肺组织中的AT2细胞(图4c)。以此模型作为对照,他们评估了处于8周(早期)、12周(中期)和16周(晚期)肿瘤进展时期的LUAD免疫肽组,发现肿瘤的免疫肽组特征随着肿瘤进展逐渐偏离正常组织,且富集肿瘤免疫肽组的细胞表型,从AT2细胞转向了club/BASC细胞和基底细胞(图4d-f)。
于是,根据免疫肽组的时序变化,Jacks团队进一步分析了肿瘤进展对免疫肽组的影响及其相关的生物学特征。在KP模型中,他们观察到了多肽特征的动态变化,且肿瘤晚期特征与胃上皮模块、高度混合转录基因模块的相关性增加(图4g-h)。
GSEA分析表明,晚期肿瘤多肽特征与炎症细胞因子信号通路正相关,与Myc信号通路、代谢过程和上皮-间充质转化(EMT)负相关(图4i)。此外,他们还关注了KP肿瘤细胞的转移簇特征,说明了MHC-I呈递存在显著的肿瘤内和肿瘤间异质性(图4j-k)。
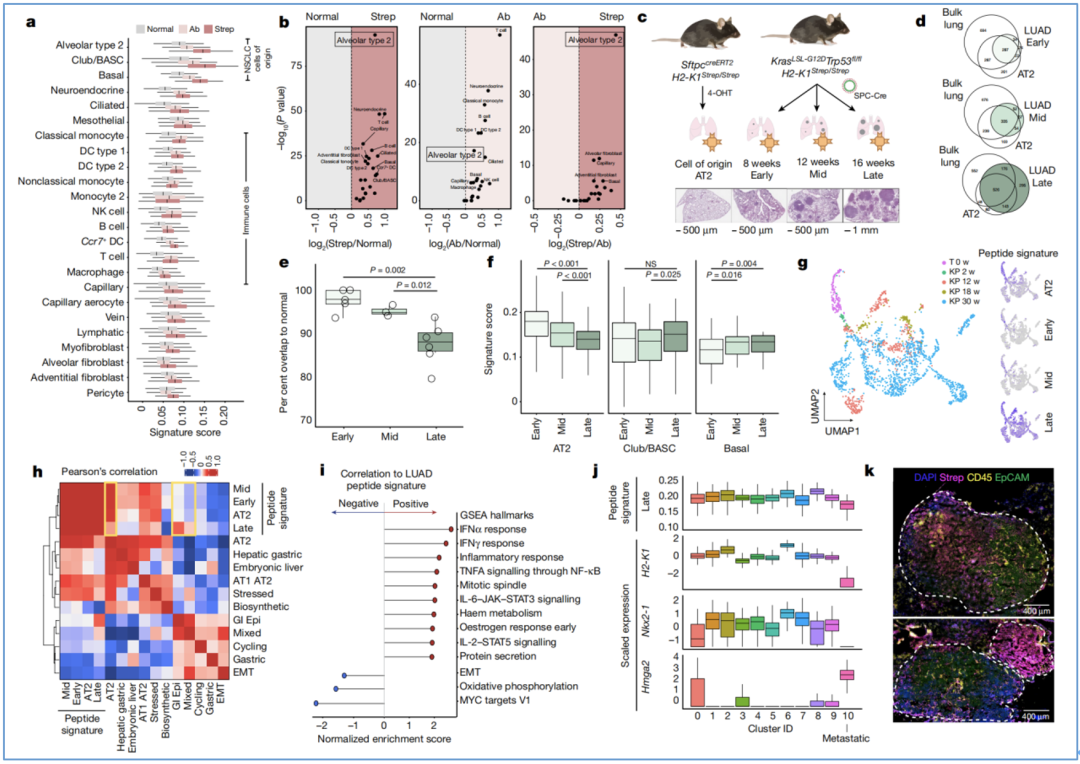
图4 LUAD免疫肽组在整个肿瘤进化过程中是动态的和异质的
前面的探索虽然阐明了来自KP肿瘤的广泛免疫肽组特征,但并未说明与健康的肺或正常AT2细胞相比,KP肿瘤中特异的肽的特征(图5a)。因此,为了了解转录过程和LUAD特异性肽呈递之间的关系,他们将LUAD进展过程中编码LUAD特异性肽的基因的相对mRNA表达水平,与正常AT2细胞中的进行比较,发现LUAD特异性肽的呈递效率与平均mRNA表达水平或预测的肽亲和力均无关(图5b)。
这也就意味着,mRNA表达的变化不能完全解释单个肽的LUAD特异性呈递效率。Jacks团队通过对肿瘤进展任何阶段都上调的基因进行鉴定,及对其相应多肽的亲和力进行预测,最终只有39个为LUAD特异性肽,这也证明了以往使用RNA表达水平或亲和力预测等方法筛选肿瘤特异性抗原肽的局限性(图5c)。
相应地,Jacks团队还评估了肿瘤细胞或正常细胞中的蛋白质合成是否可以更好地预测LUAD特异性肽的呈递。他们获得了正常AT2细胞和KP LUAD细胞的类器官培养物,并在体外进行了核糖体分析(Ribo-seq)和转录组测序(RNA-seq)。分析结果表明,与这两种类器官各自特征相关的基因均表现出更高的翻译率(图5d-e)。
综合分析Ribo-seq、RNA-seq数据后,Jacks团队发现,有些基因在两种类器官之间有明显的mRNA或RPF(Ribosome Protected Fragment)丰度差异,但编码LUAD特异性肽的基因却通常没有差异,且通过TE(Translation Efficiency)预测所得的肽与LUAD特异性肽的重复率非常低(图5f-g),这也就是说,通过蛋白质合成也不能很好地预测肿瘤特异性抗原肽。
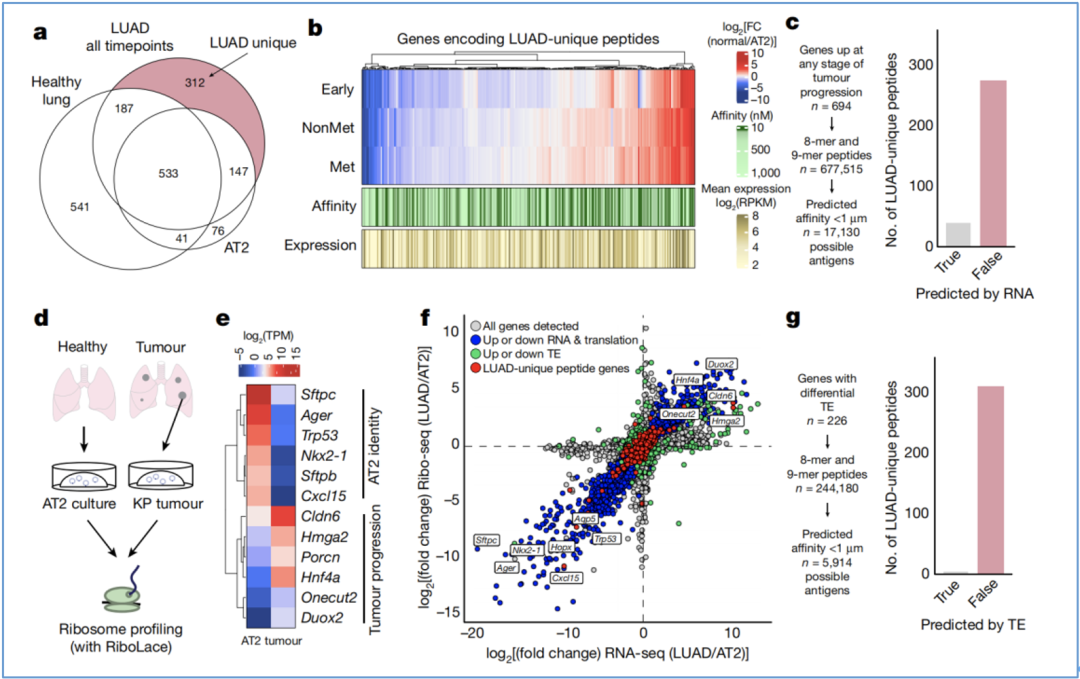
图5 LUAD特异性多肽的转录和翻译
最后,Jacks团队在KP/KbStrep模型中发现了135个推测的非突变肿瘤特异性抗原(TSAs)和147个推测的肿瘤相关抗原(TAAs)(图6a)。
为了验证这两类抗原的免疫原性,他们用一种混合肽树突状细胞(DC)疫苗(3种TSAs,5种TAAs)接种小鼠,并使用ELISpot技术检测IFN-γ的分泌(代表着T细胞的应答水平,侧面反映抗原的免疫原性);最终他们发现了三种免疫原性肽,其中两种是无法在体外筛选到的,且难以通过RNA或RPF的表达进行预测(图6b-d)。
进一步,他们利用tetramer技术对接种了5周疫苗的KP荷瘤小鼠的CD8+T细胞反应性进行评估(图6e-f),证明了被激活的T细胞确实能识别特定序列的肿瘤抗原肽。对其余五个缺乏免疫原性的多肽,他们也进行了分析,这些多肽在健康小鼠中被发现主要集中于AT2细胞,而在广泛的肺组织中则表达很低,从而导致了错误的推测(图6g)。
以上分析也表明,与体外或芯片筛选方法相比,体内的细胞特异性免疫肽组学提供了通过经验评估细胞特异性和组织特异性呈递模式的机会,并能更准确地分类潜在抗原(图6h)。
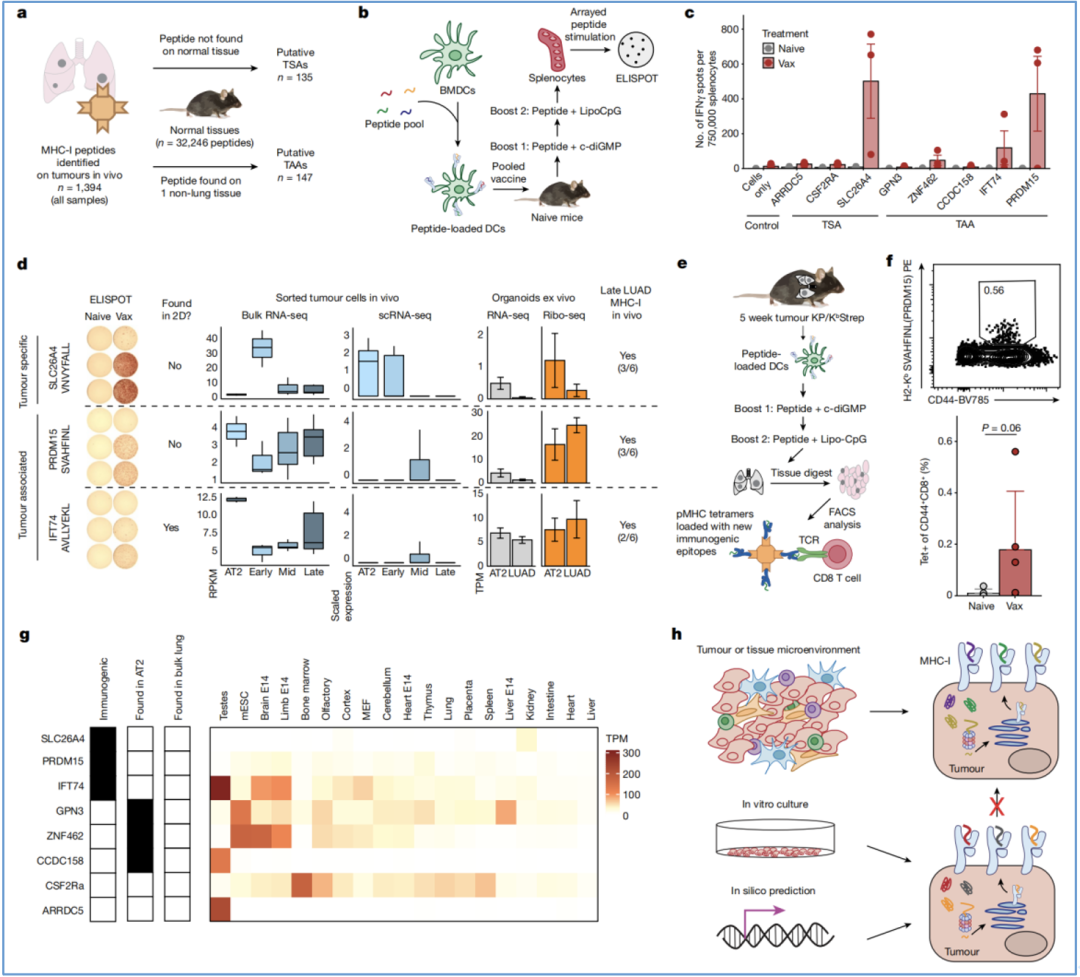
图6 在LUAD中发现新的肿瘤抗原
总的来说,Jacks团队的这项研究不仅揭示了体内肿瘤免疫肽组能促进对环境特异性抗原呈递的进一步研究,提高我们对肿瘤-免疫相互作用的理解;还提供了一个通用的小鼠模型,协助研究者更广泛地探索在健康和疾病中具有高分辨率的抗原呈递机制。
期待这个研究能给我们带来更准确的癌症抗原表位和更好的癌症免疫疗法。
参考文献
[1] Ghorani E, Reading JL, Henry JY, et al. The T cell differentiation landscape is shaped by tumour mutations in lung cancer. Nat Cancer. 2020;1(5):546-561. doi:10.1038/s43018-020-0066-y
[2] Dersh D, Hollý J, Yewdell JW. A few good peptides: MHC class I-based cancer immunosurveillance and immunoevasion [published correction appears in Nat Rev Immunol. 2020 Sep 1;:]. Nat Rev Immunol. 2021;21(2):116-128. doi:10.1038/s41577-020-0390-6
[3] Schumacher TN, Schreiber RD. Neoantigens in cancer immunotherapy. Science. 2015;348(6230):69-74. doi:10.1126/science.aaa4971
[4] Miao D, Margolis CA, Vokes NI, et al. Genomic correlates of response to immune checkpoint blockade in microsatellite-stable solid tumors. Nat Genet. 2018;50(9):1271-1281. doi:10.1038/s41588-018-0200-2
[5] Jaeger AM, Stopfer LE, Ahn R, et al. Deciphering the immunopeptidome in vivo reveals new tumour antigens. Nature. 2022;607(7917):149-155. doi:10.1038/s41586-022-04839-2
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


