GPRC5DxCD3双特异性抗体!美国FDA授予强生talquetamab突破性疗法认定:治疗复发/难治性多发性骨髓瘤(R/R MM)!
来源:网络 2022-06-30 15:59
图片来源于:摄图网
图片来源于:摄图网
2022年06月30日讯 /生物谷BIOON/ --强生(JNJ)旗下杨森制药公司近日宣布,美国食品和药物管理局(FDA)已授予GPRC5DxCD3双特异性抗体talquetamab(JNJ-64407564)突破性疗法认定(BTD):用于治疗先前接受过至少4种疗法(包括蛋白酶体抑制剂、免疫调节剂、抗CD38抗体)的复发或难治性多发性骨髓瘤(R/R MM)成人患者。这标志着杨森在肿瘤学领域获得的第12个BTD,也是该公司双特异性抗体产品组合获得的第3个BTD。2021年,欧洲药品管理局(EMA)授予了talquetamab优先药物资格(PRIME)。
talquetamab是一种首创(first-in-class)、即用型(off-the-shelf)T细胞重定向双特异性抗体,同时靶向GPRC5D(多发性骨髓瘤上的新颖靶标)和CD3(抗癌T细胞上的表面受体)。GPRC5D(G蛋白偶联受体C5家族亚型D)在多发性骨髓瘤上高度表达,CD3参与激活T细胞。临床前研究结果表明,talquetamab通过招募和激活CD3阳性T细胞,诱导T细胞介导的GPRC5D阳性多发性骨髓瘤细胞的杀伤,并抑制肿瘤的形成和生长。
GPRC5D是治疗多发性骨髓瘤的一个新靶点,作为一种双特异性抗体,通过靶向CD3与T细胞结合,talquetamab正被开发作为先前接受过多种疗法(heavily pre-treated,过度预治疗)R/R MM患者群体的一种潜在新治疗选择。
FDA授予talquetamab BTD,基于1/2期首个人体剂量递增研究MonumenTAL-1(1期:NCT03399799;2期:NCT04634552)的结果。该研究在先前接受过大量方案治疗(中位数为6种)的R/R MM患者中开展。该研究的数据已在今年的美国临床肿瘤学会(ASCO)年会上公布,数据显示:在推荐的皮下2期剂量(RP2D)下,talquetamab每周一次(QW)或每2周一次(Q2W)治疗显示出令人鼓舞的治疗反应。
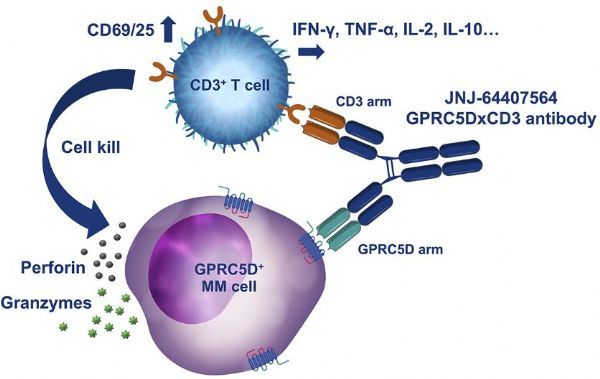
talquetamab(JNJ-64407564,图片来源于文献:PMID:32040549)
MonumenTAL-1研究的主要目标是确定推荐的皮下2期剂量(RP2D,第一部分),并评估talquetamab在推荐剂量下的安全性和耐受性(第二部分)。截至2022年4月6日,已有130例复发或对既往疗法不耐受的多发性骨髓瘤(MM)患者接受了talquetamab治疗。对于第二部分,30例患者在递增剂量后接受了RP2D 405μg/kg每周一次(QW)治疗方案:100%接受过三类药物(蛋白酶体抑制剂[PI],免疫调节药物[IMiD],CD38抗体)暴露,80%为5种药物暴露(2种PI、2种IMiD、1种CD38抗体),76.7%为三类药物难治性,20%为5种药物难治性,30%曾接受过B细胞成熟抗原(BCMA)靶向疗法。44例患者接受了RP2D 800μg/kg每2周一次(Q2W)治疗方案:97.7%为三类药物暴露,68.2%为5种药物暴露,77.3%为三类药物难治性,27.3%为5种药物难治性,27.3%曾接受过BCMA靶向疗法。三类疗法难治和五种药物难治的MM患者由于治疗方案有限,生存预后很差。
数据显示,2种剂量下talquetamab治疗的总缓解率(ORR)一致。接受405 μg/kg QW剂量治疗的患者,中位随访13.2个月(范围1.1-24),有70%(21/30)实现病情缓解(ORR=70%),有56.7%实现非常好的部分缓解(VGPR)或更好缓解,有6.7%实现完全缓解(CR),有23.3%实现严格的完全缓解(sCR)。接受800µg/kg Q2W治疗的患者,中位随访7.7个月(范围0.7-16),有63.6%(28/44)实现病情缓解(ORR=70%),有56.8%实现非常好的部分缓解(VGPR)或更好缓解,有11.4%实现完全缓解(CR),有9.1%实现严格的完全缓解(sCR)。中位缓解持续时间(DOR)方面,405µg/kg QW剂量组为10.2个月(95%CI:3.0-不可估计),800µg/kg QW剂量组为13.0个月(95%CI:5.3-不可估计)。
在可评价疗效的三类药物难治性患者中,65.2%(15/23)接受405µg/kg QW剂量治疗的患者、67.6%(23/34)接受800µg/kg Q2W剂量治疗的患者实现病情缓解。在5种药物难治性(penta-drug refractory)患者中,83.3%(5/6)接受405µg/kg QW剂量治疗的患者、75%(9/12)接受800µg/kg Q2W剂量治疗的患者实现病情缓解。
长期随访期间,每个治疗队列没有发现新的安全性信号。在405 µg/kg QW剂量下,最常见的不良事件(AE)是细胞因子释放综合征(CRS;76.7%;3.3%为3/4级)、中性粒细胞减少症(66.7%;60%为3/4级)、皮肤相关不良事件(66.7%;全部为1/2级)和嗅觉障碍(63.3%;全部为1/2级)。在800µg/kg Q2W剂量下,最常见的不良事件为CRS(79.5%;全部为1/2级)、皮肤相关不良事件(72.7%;2.3%为3/4级)和嗅觉障碍(56.8%)。味觉障碍在支持性护理下进行治疗,如有必要,进行剂量调整。细胞减少症主要局限于递增剂量和周期1和周期2,通常在一周内解决。在405 μg/kg QW剂量下,46.7%(3/4级,6.7%)的患者发生感染,在800μg/kg Q2W剂量下,38.6%(3/4级,9.1%)的患者发生感染。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


